题目内容
1.一定温度下,发生反应:FeO(s)+CO(g)?Fe(s)+CO2(g);△H,已知该反应在不同温度下的平衡常数如表:| 温度/℃ | 1000 | 1100 |
| 平衡常数 | 0.68 | 0.50 |
(1)该反应的△H<0
(2)T℃时,将FeO(s)和CO(g)各3.0mol加入10L的密闭容器中,反应达到平衡后,测得CO转化率为α1,c(CO2)=0.15mol•L-1,则温度T低于(填高于、低于、等于)1000,若此时保持其它条件不变再充入2.0mol CO(g),再达平衡时测得CO转化率为α2,则α1=α2(填>、<或=).
分析 ①根据温度和平衡常数以及反应的吸放热之间的关系来回答;
②计算1000℃时CO的转化率以及二氧化碳的平衡浓度,根据三行式计算比较.
解答 解:(1)该反应的K随着温度的升高而减小,所以反应释放热量,△H<0,故答案为:<;
(2)T℃时,将FeO(s)和CO(g)各3.0mol加入10L的密闭容器中,
FeO(s)+CO(g)?Fe(s)+CO2(g)
初始浓度:0.3 0.3 0 0
变化浓度:0.15 0.15
平衡浓度:0.15 0.15
CO转化率为α1=$\frac{0.15}{0.3}$×100%=50%,c(CO2)=0.15mol•L-1,K=1,
则温度低于1000℃,
T℃时,若此时保持其它条件不变再充入2.0mol CO(g),设变化的CO浓度是x,
FeO(s)+CO(g)?Fe(s)+CO2(g)
初始浓度:0.3 0.5 0 0
变化浓度:x x
平衡浓度:0.5-x x
$\frac{x}{0.5-x}$=1,x=0.25,
则α2=50%,
故答案为:低于;=.
点评 本题考查化学平衡的计算,为高频考点,侧重考查学生的分析能力和计算能力的考查,涉及化学平衡移动原理以及三行式的计算知识,属于综合知识的考查,难度中等.

练习册系列答案
相关题目
12. 铁及其化合物在日常生活、生产中应用广泛,研究铁及其化合物的应用意义重大.回答下列问题:
铁及其化合物在日常生活、生产中应用广泛,研究铁及其化合物的应用意义重大.回答下列问题:
(1)已知高炉炼铁过程中会发生如下反应:
FeO(s)+CO(g)═Fe(s)+CO2(g)△H1
Fe2O3(s)+$\frac{1}{3}$CO(g)═$\frac{2}{3}$Fe3O4(s)+$\frac{1}{3}$CO2(g)△H2
Fe3O4(s)+CO(g)═3Fe(s)+CO2(g)H3
Fe2O3(s)+CO(g)═2Fe(s)+3CO2(g)H4
则△H4的表达式为△H2+$\frac{2}{3}$△H3(用含△H1、△H2、△H3的代数式表示).
(2)上述反应在高炉中大致分为三个阶段,各阶段主要成分与温度的关系如下:
1600℃时固体物质的主要成分为FeO和Fe,该温度下若测得固体混合物中m(Fe):m(O)=35:2,则FeO被CO还原为Fe的百分率为80%(设其它固体杂质中不含Fe、O元素).
(3)铁等金属可用作CO与氢气反应的催化剂.已知某种催化剂可用来催化反应 CO(g)+3H2(g)?CH4(g)+H2O(g)△H<0.在T℃,106Pa时将l mol CO和3mol H2加入体积可变的密闭容器中.实验测得CO的体积分数x(CO)如下表:
①能判断CO(g)+3H2(g)?CH4(g)+H2O(g)达到平衡的是bd(填序号).
a.容器内压强不再发生变化 b.混合气体的密度不再发生变化
c.v正(CO)=3v逆(H2) d.混合气体的平均相对分子质量不再发生变化
②达到平衡时CO的转化率为37.1%;在T℃106Pa时该反应的压强平衡常数Kp(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)的计算式为$\frac{(\frac{0,371}{3.258})^{2}}{0.193×(\frac{1.887}{3.258})^{3}×1{0}^{12}P{a}^{2}}$;
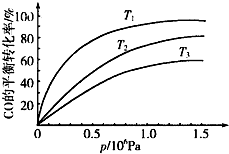
③图表示该反应CO的平衡转化率与温度、压强的关系.图中温度T1、T2、T3由高到低的顺序是T3>T2>T1,理由是正反应放热,在相同压强下,温度降低,平衡向正反应方向移动,CO的转化率越高.
 铁及其化合物在日常生活、生产中应用广泛,研究铁及其化合物的应用意义重大.回答下列问题:
铁及其化合物在日常生活、生产中应用广泛,研究铁及其化合物的应用意义重大.回答下列问题:(1)已知高炉炼铁过程中会发生如下反应:
FeO(s)+CO(g)═Fe(s)+CO2(g)△H1
Fe2O3(s)+$\frac{1}{3}$CO(g)═$\frac{2}{3}$Fe3O4(s)+$\frac{1}{3}$CO2(g)△H2
Fe3O4(s)+CO(g)═3Fe(s)+CO2(g)H3
Fe2O3(s)+CO(g)═2Fe(s)+3CO2(g)H4
则△H4的表达式为△H2+$\frac{2}{3}$△H3(用含△H1、△H2、△H3的代数式表示).
(2)上述反应在高炉中大致分为三个阶段,各阶段主要成分与温度的关系如下:
| 温度 | 250℃ | 600℃ | 1000℃ | 2000℃ |
| 主要成分 | Fe2O3 | Fe3O4 | FeO | Fe |
(3)铁等金属可用作CO与氢气反应的催化剂.已知某种催化剂可用来催化反应 CO(g)+3H2(g)?CH4(g)+H2O(g)△H<0.在T℃,106Pa时将l mol CO和3mol H2加入体积可变的密闭容器中.实验测得CO的体积分数x(CO)如下表:
| t/min | 0 | 10 | 20 | 30 | 40 | 50 |
| x(CO) | 0.25 | 0.23 | 0.214 | 0.202 | 0.193 | 0.193 |
a.容器内压强不再发生变化 b.混合气体的密度不再发生变化
c.v正(CO)=3v逆(H2) d.混合气体的平均相对分子质量不再发生变化
②达到平衡时CO的转化率为37.1%;在T℃106Pa时该反应的压强平衡常数Kp(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)的计算式为$\frac{(\frac{0,371}{3.258})^{2}}{0.193×(\frac{1.887}{3.258})^{3}×1{0}^{12}P{a}^{2}}$;
③图表示该反应CO的平衡转化率与温度、压强的关系.图中温度T1、T2、T3由高到低的顺序是T3>T2>T1,理由是正反应放热,在相同压强下,温度降低,平衡向正反应方向移动,CO的转化率越高.
9.已知:t℃下的某一气态平衡体系中含有X(g)、Y(g)、Z(g)、W(g)四种物质,此温度下发生反应的平衡常数表达式为:K=$\frac{c(X)•{c}^{2}(Y)}{{c}^{2}(Z)•{c}^{2}(W)}$,有关该平衡的说法中正确的是( )
| A. | 升高温度,平衡常数K变大 | |
| B. | 增大压强,W(g)物质的量分数变大 | |
| C. | 升温,若混合气体的平均相对分子质量变小,则正反应放热 | |
| D. | 增大X浓度,平衡向正反应方向移动 |
16.恒温条件下,反应N2(g)+3H2(g)?2NH3(g)在密闭容器中达到平衡状态,混合气体的平均摩尔质量为$\overline{M}$,N2与NH3的浓度均为c mol/L.若将容器的容积压缩为原来的$\frac{1}{2}$,当达到新平衡时,下列说法中正确的是( )
| A. | 新的平衡体系中,N2的浓度小于2c mol/L大于c mol/L | |
| B. | 新的平衡体系中,NH3的浓度小于2c mol/L大于c mol/L | |
| C. | 新的平衡体系中,混合气体的平均摩尔质量小于$\overline{M}$ | |
| D. | 新的平衡体系中,气体的密度是原平衡体系的1倍 |
10.设NA为阿伏加德罗常数的数值,下列说法中正确的是( )
| A. | 标准状况下,22.4L氯气与足量氢氧化钠溶艘反应转移的电子数为2NA | |
| B. | 将含有1molFeCl3的饱和溶液加入到沸水中得到氢氧化铁胶体,其中胶体粒子的数目为NA | |
| C. | 两份2.7g铝分别与100 mL浓度为2mol•L-1的盐酸和氢氧化钠溶液充分反应,转移的电子数均为0.3NA | |
| D. | 通常情况下,16g CH4中含有4NA个C-H键 |


 (1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有湿润有色布条的广口瓶,可观察到的现象是干燥的有色布条无明显现象,潮湿的有色布条褪色.
(1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有湿润有色布条的广口瓶,可观察到的现象是干燥的有色布条无明显现象,潮湿的有色布条褪色.