题目内容
7.下列有关烃的系统命名正确的有( )| A. | 2,3-二甲基-3,3-二乙基戊烷 | B. | 2-甲基-3-乙基丁烷 | ||
| C. | 2,3-二甲基-1-丁烯 | D. | 2,3-二甲基-1-丁炔 |
分析 判断有机物的命名是否正确或对有机物进行命名,其核心是准确理解命名规范:
(1)烷烃命名原则:
①长-----选最长碳链为主链;
②多-----遇等长碳链时,支链最多为主链;
③近-----离支链最近一端编号;
④小-----支链编号之和最小.看下面结构简式,从右端或左端看,均符合“近-----离支链最近一端编号”的原则;
⑤简-----两取代基距离主链两端等距离时,从简单取代基开始编号.如取代基不同,就把简单的写在前面,复杂的写在后面.
(2)有机物的名称书写要规范;
(3)对于结构中含有苯环的,命名时可以依次编号命名,也可以根据其相对位置,用“邻”、“间”、“对”进行命名;
(4)含有官能团的有机物命名时,要选含官能团的最长碳链作为主链,官能团的位次最小.
解答 解:A.3号碳连接超过5个键,最多连4个,故A错误;
B.主链不是最长,名称为2,3二甲基戊烷,故B错误;
C.符合命名规则,故C正确;
D.2号碳连接超过5个键,最多连4个,故D错误.
故选C.
点评 本题考查了有机物相同命名方法的应用,注意主链选择,起点编号,官能团位次,名称书写的规范是解题关键,题目较简单.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
17.前四周期的A、B、C、D四种元素在周期表中均与元素X紧密相邻.已知元素X最高价氧化物的化学式为X2O5,B、D同主族且B元素的原子半径是同族元素中最小的,C的最高价氧化物对应的水化物是强酸.
(1)D元素基态原子的电子排布式为1s22s22p63s23p63d104s24p3或[Ar]3d104s24p3.
(2)A、C、X三种元素原子的第一电离能由大到小的顺序为P>S>Si(用相应的元素符号作答).
(3)B、X、D氢化物的沸点由高到低的顺序为NH3>AsH3>PH3(用相应的化学式作答).
(4)E元素是A元素所在周期中电负性最大的,试推测下列微粒的立体构型:
(5)元素B的一种氢化物B2H4具有重要的用途.有关B2H4的说法正确的是AB.(选填字母)
A.B2H4分子间可形成氢键 B.B原子是sp3杂化
C.B2H4分子中含有5个σ键和1个π键 D.B2H4晶体变为液态时破坏共价键
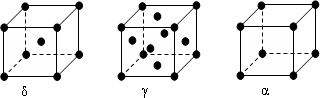
(6)F元素基态原子M层上有5对成对电子,请解释F晶体能导电的原因铁是金属晶体,由金属阳离子和自由电子组成,自由电子在外加电场的作用下可发生定向移动,因此铁能导电.F形成的单质有δ、γ、α三种同素异形体,三种晶胞(如图所示)中F原子的配位数之比为4:6:3,δ、γ、α三种晶胞的边长之比为$\frac{2}{\sqrt{3}}$:$\sqrt{2}$:1.
(1)D元素基态原子的电子排布式为1s22s22p63s23p63d104s24p3或[Ar]3d104s24p3.
(2)A、C、X三种元素原子的第一电离能由大到小的顺序为P>S>Si(用相应的元素符号作答).
(3)B、X、D氢化物的沸点由高到低的顺序为NH3>AsH3>PH3(用相应的化学式作答).
(4)E元素是A元素所在周期中电负性最大的,试推测下列微粒的立体构型:
| 微粒 | EO2- | EO3- |
| 立体构型名称 |
A.B2H4分子间可形成氢键 B.B原子是sp3杂化
C.B2H4分子中含有5个σ键和1个π键 D.B2H4晶体变为液态时破坏共价键
(6)F元素基态原子M层上有5对成对电子,请解释F晶体能导电的原因铁是金属晶体,由金属阳离子和自由电子组成,自由电子在外加电场的作用下可发生定向移动,因此铁能导电.F形成的单质有δ、γ、α三种同素异形体,三种晶胞(如图所示)中F原子的配位数之比为4:6:3,δ、γ、α三种晶胞的边长之比为$\frac{2}{\sqrt{3}}$:$\sqrt{2}$:1.

18.高氯酸、硫酸、硝酸和盐酸都是强酸,其酸性在水溶液中差别不大.四种物质在冰醋酸中的电离常数
从以上表格中判断以下说法中不正确的是( )
| HClO4 | H2SO4 | HCl | HNO3 | |
| Ka | 1.6×10-5 | 6.3×10-9 | 1.6×10-9 | 4.2×10-10 |
| A. | 在冰醋酸中高氯酸是这四种酸中最强的酸 | |
| B. | 在冰醋酸中硫酸的电离方程式为H2SO4═2H++SO42- | |
| C. | 在冰醋酸中这四种酸都没有完全电离 | |
| D. | 酸的强弱与其本身的结构和溶剂的性质有关 |
15.小明同学的化学纠错本上有如下内容,其中原因分析及改正有误的是( )
| 错误 | 原因分析及改正 | |
| A | FeBr2溶液中通入少量Cl2的离子方程式: 2Br-+Cl2═Br2+2Cl- | 还原性强弱:Fe2+>Br-; 改正:2Fe2++Cl2=2Fe3++2Cl-. |
| B | 除去CO2中的HCl气体:通过饱合Na2CO3溶液,分离方法:洗气 | “饱合”应为“饱和”,Na2CO3不仅要吸收HCl气体,还要吸收CO2,应改用饱和NaHCO3溶液;分离方法:洗气. |
| C | 用已知浓度的HCl溶液滴定未知浓度的NaOH溶液.指示剂:甲基橙,终点判断:当滴至最后一滴标准液,溶液由黄色变为橙色,即达终点. | 指示剂不能用甲基橙,改用酚酞,终点判断:当滴至最后一滴标准液,溶液由红色变为浅红色,即达终点. |
| D | 双原子分子一定是非极性分子 | 双原子分子有可能为单质或化合物分子; 改正:双原子单质分子一定是非极性分子而双原子化合物分子一定是极性分子. |
| A. | A | B. | B | C. | C | D. | D |
19.下列物质中,属于新型无机非金属材料的是( )
| A. | 钢化玻璃 | B. | 氮化硅陶瓷 | C. | 光导纤维 | D. | 陶瓷 |
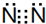 .
.