题目内容
8.碳酸钠与工农业生产、日常生活紧密相关.工业碳酸钠大多采用侯氏制碱法制取,所得碳酸钠样品中往往含有少量NaCl,现欲测定样品中Na2CO3的质量分数,某探究性学习小组分别设计了如下实验方案.请回答下列有关问题:方案一:沉淀分析法
(1)把一定质量的样品溶解后加入过量的CaCl2溶液,将所得沉淀过滤(填操作)、洗涤、烘干、称量,洗涤沉淀的操作是向过滤器中的沉淀加蒸馏水至浸没过沉淀物,使水自然流下,重复2~3次.
方案二:气体分析法
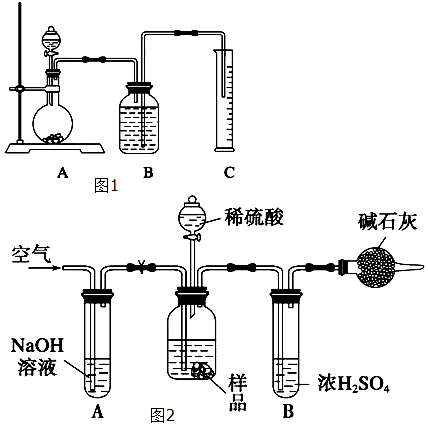
(2)把一定量的样品与足量盐酸反应后,用图1所示装置测定产生CO2的体积,为了确保测定结果的准确性,B中的溶液最好采用饱和NaHCO3溶液,但选用该溶液后实验结果仍然不够准确,其原因是CO2气体中混有的HCl气体与NaHCO3溶液作用生成CO2.
方案三:质量差分析法
(3)把一定质量的样品和足量的稀硫酸反应,采用图2所示装置,通过称量反应前后盛有碱石灰的干燥管的质量,利用其质量差求算样品的纯度.
该实验的操作步骤有:①在干燥管内填满碱石灰,质量为m g;②取n g样品装入广口瓶中;③检验装置的气密性;④缓慢鼓入空气数分钟,再称量干燥管质量为w g;⑤关闭止水夹;⑥打开止水夹;⑦缓慢加入稀硫酸至不再产生气体为止;⑧缓慢鼓入空气数分钟.
Ⅰ.正确的操作顺序是(填序号):
③-→②-→⑥-→⑧-→⑤-→①-→⑦-→⑥-→④.
Ⅱ.若去掉装置A,测定结果偏大;若去掉装置B,测定结果偏大(填“偏大”、“偏小”或“无影响”).
分析 (1)测定样品中Na2CO3的质量分数,样品溶解后加入过量的CaCl2溶液会生成沉淀,分离方法为过滤,洗涤沉淀的操作是在过滤器中加水浸没沉淀使水自然留下,重复操作2-3次;
(2)把一定量的混合物与足量盐酸反应,然后用如图装置测定产生的CO2气体的体积,是利用排液法测定生成二氧化碳的气体体积进行计算,广口瓶中液体是饱和碳酸氢钠;若直接采用如图乙装置,选用该溶液后实验结果仍然不够准确,依据气体中的氯化氢会和碳酸氢钠溶液反应生成二氧化碳气体;
(3)Ⅰ、依据装置图分析气体通过需要先检查装置气密性,称取n g样品装入广口瓶中,打并止水夹,缓慢鼓入空气数分钟用来赶净装置中的空气,关闭止水夹,在干燥管内填满碱石灰,质量为m g,缓慢加入稀硫酸至不再产生气体为止,打开止水夹,缓慢鼓入空气数分钟,把生成的二氧化碳全部赶到碱石灰干燥管中全部吸收,再称量干燥管质量为w g计算;
Ⅱ、若去掉装置A,空气中的二氧化碳会被碱石灰吸收,测定结果偏高,若去掉装置B,气体中的水蒸气会被碱石灰吸收,测定结果增大.
解答 解:(1)测定样品中Na2CO3的质量分数,样品溶解后加入过量的CaCl2溶液会生成沉淀,分离方法为过滤,洗涤沉淀的操作是在过滤器中加水浸没沉淀使水自然留下,重复操作2-3次;
故答案为:过滤;向过滤器中的沉淀加蒸馏水至浸没过沉淀物,使水自然流下,重复2~3次;
(2)利用测定反应生成的二氧化碳气体体积的方法测定,在碳酸氢钠溶液中二氧化碳不反应,溶解度减小,利用装置图排饱和碳酸氢钠溶液测定二氧化碳气体的体积,但选用该溶液后实验结果仍然不够准确,其原因可能是CO2气体中混有的HCl气体与NaHCO3溶液作用生成CO2;
故答案为:饱和NaHCO3溶液;CO2气体中混有的HCl气体与NaHCO3溶液作用生成CO2;
(3)Ⅰ、依据装置图分析,结合操作顺序中的给定步骤位置,实验顺序为:先检查装置气密性,称取n g样品装入广口瓶中,打开止水夹,缓慢鼓入空气数分钟用来赶净装置中的空气,关闭止水夹,在干燥管内填满碱石灰,质量为m g,缓慢加入稀硫酸至不再产生气体为止,打开止水夹,缓慢鼓入空气数分钟,把生成的二氧化碳全部赶到碱石灰干燥管中全部吸收,再称量干燥管质量为w g计算,故正确的顺序为③→②→⑥→⑧→⑤→①→⑦→⑥→④;
故答案为:②;⑧;①;⑥;
Ⅱ、若去掉装置A,空气中的二氧化碳会被碱石灰吸收,测定结果偏高,若去掉装置B,气体中的水蒸气会被碱石灰吸收,测定结果增大;
故答案为:偏大;偏大.
点评 本题主要考查二氧化碳和碱石灰的反应,通过本题我们要知道在完成实验时要尽可能的排除可能对实验结果产生影响的因素,例如本题中空气中二氧化碳对实验结果的影响,水蒸气的影响等,题目难度中等.

| 元素 | 各电子层的电子数 | |||
| K | L | M | N | |
| A | 2 | 7 | ||
| B | 2 | 8 | 1 | |
| C | 2 | 8 | 18 | 7 |
| D | 2 | 8 | 2 | |
| E | 2 | 8 | 7 | |
(2)属于同一主族的元素是A、C、E.
(3)B单质与水反应的化学反应方程式是2Na+2H2O=2NaOH+H2↑.
(4)E单质与水反应的化学反应方程式是Cl2+H2O=HCl+HClO.
| A. | 酸式滴定管可以用来装所有的酸或酸性溶液 | |
| B. | 灼烧Na2CO3•10H2O 晶体时应选用耐高温的石英坩埚 | |
| C. | 实验室制取乙酸乙酯时用饱和NaHCO3溶液收集产物 | |
| D. | 测定溶液的pH时,在玻璃板上放一片干燥的pH试纸,用玻璃棒蘸取取待试液滴到pH试纸上,把试纸与标准比色卡比较,读出溶液的pH |
| A. | 在相同的条件下,红磷比白磷稳定 | |
| B. | 在相同的条件下,白磷比红磷稳定 | |
| C. | 红磷和白磷的化学性质相同 | |
| D. | 红磷容易发生自燃而白磷则不会自燃 |
| A. |  酚类-OH 酚类-OH | B. | CH3COCH3 醚类 C-O-C | ||
| C. |  醛类-CHO 醛类-CHO | D. |  酮类 C═O 酮类 C═O |
| A. | 电解质溶液 | B. | 负极材料 | C. | 正极反应 | D. | 负极反应 |

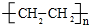

 +NaOH$→_{△}^{CH_{3}CH_{2}OH}$
+NaOH$→_{△}^{CH_{3}CH_{2}OH}$ +NaCl+H2O.
+NaCl+H2O. 任意一种.
任意一种.
 ,B的结构简式是
,B的结构简式是 .
. .
.