题目内容
16.下列说法正确的是( )| A. | 反应2Mg+CO2$\frac{\underline{\;\;△\;\;}}{\;}$2MgO+C△H<0从熵变角度看,可自发进行 | |
| B. | 在密闭容器发生可逆反应:2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-113.0 kJ/mol,达到平衡后,保持温度不变,缩小容器体积,重新达到平衡后,△H变小 | |
| C. | 已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=2.0×10-12,将等体积浓度为1.0×10-4mol/L的AgNO3溶液滴入到浓度均为1.0×10-4mol/L的KCl和K2CrO4的混合溶液中产生两种不同沉淀,且Ag2CrO4沉淀先产生 | |
| D. | 根据HClO的Ka=3.0×10-8,H2CO3的Ka1=4.3×10-7,Ka2=5.6×10-11,可推测相同状况下,等浓度的NaClO与Na2CO3溶液中,pH前者小于后者 |
分析 A.反应的△S<0,从熵变角度看不利于反应的进行;
B.平衡发生移动,反应热不变;
C.根据Ksp(AgCl)、Ksp(Ag2CrO4)计算生成AgCl、Ag2CrO4沉淀时银离子的浓度,比较大小后确定谁先沉淀;
D.酸越弱,对应的盐的碱性越强.
解答 解:A.反应的△S<0,从熵变角度看不利于反应的进行,反应能否自发进行,应满足△H-T•△S<0,故A错误;
B.平衡发生移动,反应热不变,故B错误;
C.将等体积浓度为1.0×10-4mol/L的AgNO3溶液滴入到浓度为1.0×10-4mol/L的K2CrO4的混合溶液,c(Ag+)=5.0×10-5mol/L,则c2(Ag+)×c(CrO42-)=2.5×10-13,则没有生成Ag2CrO4沉淀,如生成沉淀,则Cl-先沉淀,故C错误;
D.由电离常数可知,酸越弱,对应的盐的碱性越强,故D正确.
故选D.
点评 本题考查较为综合,涉及反应热与焓变、化学平衡移动、盐类的水解以及难溶电解质的溶解平衡等问题,为高考常见题型和高频考点,侧重于学生的分析能力和计算能力的考查,难度不大.

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
6. 氧元素和卤族元素都能形成多种物质,我们可以利用所学物质结构与性质的相关知识去认识和理解.
氧元素和卤族元素都能形成多种物质,我们可以利用所学物质结构与性质的相关知识去认识和理解.
(1)COCl2 的空间构型为平面三角形;溴的基态原子价电子排布式为4s24p5.
(2)已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,则它按下列A式发生(填字母代号,下同).
A.CsICl2═CsCl+ICl B.CsICl2═CsI+Cl2?
(3)根据下表提供的第一电离能数据判断,最有可能生成较稳定的单核阳离子的卤素原子是碘(或I).
(4)下列分子既不存在“s-p”σ 键,也不存在“p-p”π 键的是D.
A.HCl B.HF C.SO2 D.SCl2
(5)已知ClO2-为三角形,中心氯原子周围有四对价层电子.ClO3- 中心氯原子的杂化轨道类型为sp3杂化,写出一个与CN-互为等电子体的物质的分子式N2或CO.
(6)钙在氧气中燃烧时得到一种钙的氧化物晶体,其结构如图所示,由此可判断钙的氧化物的化学式为CaO2.已知该氧化物的密度是ρ g/cm3,则晶胞内离得最近的两个钙离子的间距为$\frac{\sqrt{2}}{2}×\root{3}{\frac{72×4}{ρ{N}_{A}}}$cm(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA).
 氧元素和卤族元素都能形成多种物质,我们可以利用所学物质结构与性质的相关知识去认识和理解.
氧元素和卤族元素都能形成多种物质,我们可以利用所学物质结构与性质的相关知识去认识和理解.(1)COCl2 的空间构型为平面三角形;溴的基态原子价电子排布式为4s24p5.
(2)已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,则它按下列A式发生(填字母代号,下同).
A.CsICl2═CsCl+ICl B.CsICl2═CsI+Cl2?
(3)根据下表提供的第一电离能数据判断,最有可能生成较稳定的单核阳离子的卤素原子是碘(或I).
| 氟 | 氯 | 溴 | 碘 | |
(kJ/mol) | 1681 | 1251 | 1140 | 1008 |
A.HCl B.HF C.SO2 D.SCl2
(5)已知ClO2-为三角形,中心氯原子周围有四对价层电子.ClO3- 中心氯原子的杂化轨道类型为sp3杂化,写出一个与CN-互为等电子体的物质的分子式N2或CO.
(6)钙在氧气中燃烧时得到一种钙的氧化物晶体,其结构如图所示,由此可判断钙的氧化物的化学式为CaO2.已知该氧化物的密度是ρ g/cm3,则晶胞内离得最近的两个钙离子的间距为$\frac{\sqrt{2}}{2}×\root{3}{\frac{72×4}{ρ{N}_{A}}}$cm(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA).
7.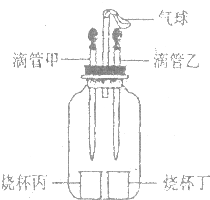 如图所示装置(气密性良好),若先将甲中液体挤出,观察到气球明显鼓起,一段时间后恢复原状;再将乙中液体挤出,气球又明显鼓起.下列组合正确的是( )
如图所示装置(气密性良好),若先将甲中液体挤出,观察到气球明显鼓起,一段时间后恢复原状;再将乙中液体挤出,气球又明显鼓起.下列组合正确的是( )
 如图所示装置(气密性良好),若先将甲中液体挤出,观察到气球明显鼓起,一段时间后恢复原状;再将乙中液体挤出,气球又明显鼓起.下列组合正确的是( )
如图所示装置(气密性良好),若先将甲中液体挤出,观察到气球明显鼓起,一段时间后恢复原状;再将乙中液体挤出,气球又明显鼓起.下列组合正确的是( )| 选项 | 滴管甲 | 烧杯丙 | 滴管乙 | 烧杯丁 |
| A | 双氧水 | 二氧化锰 | 水 | 氢氧化钠 |
| B | 盐酸 | 镁 | 盐酸 | 碳酸纳 |
| C | 水 | 氢氧化钠 | 水 | 硝酸铵 |
| D | 水 | 氧化钙 | 盐酸 | 镁 |
| A. | A | B. | B | C. | C | D. | D |
4.下列叙述不正确的是( )
| A. | 乙醇和乙酸都是常用调味品的主要成分 | |
| B. | 通过红外光谱分析可以区分乙醇与乙酸乙酯 | |
| C. | 溴丙烷水解制丙醇与丙烯和水反应制丙醇属于不同反应类型 | |
| D. | 乙醇和乙酸之间能发生酯化反应,酯化反应和皂化反应互为逆反应 |
11.如图为某高效锂硫电池.关于该电池的说法正确的是( )


| A. | 电子流向:B电极→用电器→A电极→电解质→B电极 | |
| B. | A电极上发生的一个电极反应为:2Li++S8+2e-═Li2S8 | |
| C. | 若用该电池在铁器上镀锌,电路中转移2 moI电子时,电镀池两电极质量差为65 g | |
| D. | 若用该电池电解精炼铜,负极减少7g时阳极减少质量为32 g |
8.用CuSO4•5H2O晶体配制500mL 浓度为1mol•L-1的硫酸铜溶液时,正确的是( )
| A. | 用托盘天平称取80.0g晶体用于配制溶液 | |
| B. | 将正确称取的晶体置于预先量取的500mL水中 | |
| C. | 定容前先将烧杯中溶解得到的溶液小心地直接倾倒至500mL规格的容量瓶 | |
| D. | 正确定容后,再将容量瓶塞盖好,反复上下颠倒,摇匀 |
6.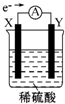 如图,在盛有稀硫酸的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是( )
如图,在盛有稀硫酸的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是( )
 如图,在盛有稀硫酸的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是( )
如图,在盛有稀硫酸的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是( )| A. | 外电路的电流方向为X→外电路→Y | |
| B. | 若两电极都是金属,则它们的活动性顺序为X<Y | |
| C. | X极上发生的是还原反应,Y极上发生的是氧化反应 | |
| D. | SO42-向X电极移动 |
 .
.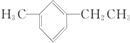 名称为1-甲基-3-乙基苯.
名称为1-甲基-3-乙基苯.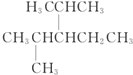 名称为:2,4-二甲基-3-乙基戊烷.
名称为:2,4-二甲基-3-乙基戊烷.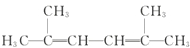 名称为:2,5-二甲基-2,4-己二烯.
名称为:2,5-二甲基-2,4-己二烯. ;
;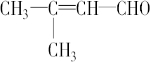 .
.