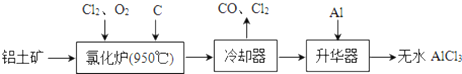
题目内容
4.下列叙述不正确的是( )| A. | 乙醇和乙酸都是常用调味品的主要成分 | |
| B. | 通过红外光谱分析可以区分乙醇与乙酸乙酯 | |
| C. | 溴丙烷水解制丙醇与丙烯和水反应制丙醇属于不同反应类型 | |
| D. | 乙醇和乙酸之间能发生酯化反应,酯化反应和皂化反应互为逆反应 |
分析 A.乙醇和乙酸是生活中的调味品,都具有特殊香味;
B.乙醇与乙酸乙酯含有的官能团、共价键不同;
C.溴丙烷水解制丙醇发生取代反应,丙烯和水反应制丙醇发生加成反应;
D.皂化反应不可逆.
解答 解:A.乙醇和乙酸是生活中的调味品,酒精调制的酒可以饮用,食醋的主要成分为乙酸,故A正确;
B.乙醇与乙酸乙酯含有的官能团、共价键不同,可通过红外光谱分析区分,故B正确;
C.溴丙烷水解制丙醇发生取代反应,丙烯和水反应制丙醇发生加成反应,反应原理不同,故C正确;
D.皂化反应为油脂的碱性条件下的水解,为不可逆反应,故D错误.
故选D.
点评 本题考查有机物的结构和性质,为高频考点,侧重于学生的分析能力的考查,有利于培养学生良好的科学素养,注意把握有机物的结构和官能团的性质,难度不大.

练习册系列答案
相关题目
14.今有一混合物的水溶液,可能含有以下离子中的若干种:K+、NH4+、Mg2+、Ba2+、Cl-、CO32-、SO42-,现取两份100mL溶液分别进行如下实验:(1)加入AgNO3溶液有沉淀产生;(2)加足量BaCl2溶液,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g.根据上述实验,以下推测正确的是( )
| A. | NH4+可能存在 | |
| B. | 若焰色反应测得K+存在,则NH4+不一定存在 | |
| C. | Cl-不可能存在 | |
| D. | Ba2+一定不存在,Mg2+可能存在 |
19.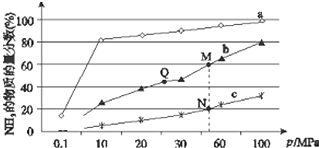 已知合成氨反应N2(g)+3H2?NH3(g)△H<0,当反应器中按n(N2):n(H2)=1:3投料后,在不同温度下,反应达到平衡时,得到混合物中NH3的物质的量分数随压强的变化曲线a、b、c如图所示.下列说法正确的是( )
已知合成氨反应N2(g)+3H2?NH3(g)△H<0,当反应器中按n(N2):n(H2)=1:3投料后,在不同温度下,反应达到平衡时,得到混合物中NH3的物质的量分数随压强的变化曲线a、b、c如图所示.下列说法正确的是( )
 已知合成氨反应N2(g)+3H2?NH3(g)△H<0,当反应器中按n(N2):n(H2)=1:3投料后,在不同温度下,反应达到平衡时,得到混合物中NH3的物质的量分数随压强的变化曲线a、b、c如图所示.下列说法正确的是( )
已知合成氨反应N2(g)+3H2?NH3(g)△H<0,当反应器中按n(N2):n(H2)=1:3投料后,在不同温度下,反应达到平衡时,得到混合物中NH3的物质的量分数随压强的变化曲线a、b、c如图所示.下列说法正确的是( )| A. | 曲线a对应的反应温度最高 | |
| B. | 上图中M、N、Q点平衡常数K的大小关系为K(M)=K(Q)<K(N) | |
| C. | 相同压强下,投料相同,达到平衡所需时间关系为c>b>a | |
| D. | N点时c(NH3)=0.2 mol/L,则N点的c(N2):c(NH3)=1:1 |
9.将一瓶盐酸分别倒入两只大烧杯中,将烧杯放在天平两边,并调节天平到指针指在分度盘中间,然后在左盘的烧杯中加10g碳酸钙,在右盘的烧杯中加入10g碳酸钠,待烧杯中固体物质完全消失后,天平指针( )
| A. | 仍在中间 | B. | 偏向左盘 | C. | 偏向右盘 | D. | 无法确定 |
16.下列说法正确的是( )
| A. | 反应2Mg+CO2$\frac{\underline{\;\;△\;\;}}{\;}$2MgO+C△H<0从熵变角度看,可自发进行 | |
| B. | 在密闭容器发生可逆反应:2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-113.0 kJ/mol,达到平衡后,保持温度不变,缩小容器体积,重新达到平衡后,△H变小 | |
| C. | 已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=2.0×10-12,将等体积浓度为1.0×10-4mol/L的AgNO3溶液滴入到浓度均为1.0×10-4mol/L的KCl和K2CrO4的混合溶液中产生两种不同沉淀,且Ag2CrO4沉淀先产生 | |
| D. | 根据HClO的Ka=3.0×10-8,H2CO3的Ka1=4.3×10-7,Ka2=5.6×10-11,可推测相同状况下,等浓度的NaClO与Na2CO3溶液中,pH前者小于后者 |
13.下列离子方程式正确的是( )
| A. | 铁和稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 氯化铝溶液中加入过量氨水制取氢氧化铝 Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| C. | 用FeCl3溶液腐蚀印刷电路板:Fe3++Cu═Fe2++Cu2+ | |
| D. | 氢氧化钠溶液中通入少量二氧化硫气体 SO2+OH-═HSO3- |
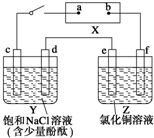 如图中X是直流电源.Y槽中c、d为石墨棒,Z槽中e、f是质量相同的铜棒.接通电路后,发现d附近显红色.
如图中X是直流电源.Y槽中c、d为石墨棒,Z槽中e、f是质量相同的铜棒.接通电路后,发现d附近显红色.