题目内容
6. 如图,在盛有稀硫酸的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是( )
如图,在盛有稀硫酸的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是( )| A. | 外电路的电流方向为X→外电路→Y | |
| B. | 若两电极都是金属,则它们的活动性顺序为X<Y | |
| C. | X极上发生的是还原反应,Y极上发生的是氧化反应 | |
| D. | SO42-向X电极移动 |
分析 根据图片知,该装置是原电池,根据电子的流向判断正负极,电流的流向正好与电子的流向相反;较活泼的金属作负极,不活泼的金属或导电的非金属作正极;负极上发生氧化反应,正极上发生还原反应.
解答 解:A、根据图片知该装置是原电池,外电路中电子从X电极流向Y电极,电流的流向与此相反,即Y→外电路→X,故A错误;
B、原电池中较活泼的金属作负极,较不活泼的金属或导电的非金属作正极,若两电极分别为Fe和碳棒,则Y为碳棒,X为Fe,故B错误;
C、X是负极,负极上发生氧化反应;Y是正极,正极上发生还原反应,故C错误;
D、原电池中电解质里的阳离子移向正极,阴离子移向负极,X是负极,SO42-向X电极移动,故D正确;
故选D.
点评 本题考查了原电池原理,难度不大,会根据电子的流向判断原电池的正负极是解本题的关键,明确正负极的判断方法、正负极上发生反应的类型、电子和电流的流向即可解答本题.

练习册系列答案
相关题目
16.下列说法正确的是( )
| A. | 反应2Mg+CO2$\frac{\underline{\;\;△\;\;}}{\;}$2MgO+C△H<0从熵变角度看,可自发进行 | |
| B. | 在密闭容器发生可逆反应:2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-113.0 kJ/mol,达到平衡后,保持温度不变,缩小容器体积,重新达到平衡后,△H变小 | |
| C. | 已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=2.0×10-12,将等体积浓度为1.0×10-4mol/L的AgNO3溶液滴入到浓度均为1.0×10-4mol/L的KCl和K2CrO4的混合溶液中产生两种不同沉淀,且Ag2CrO4沉淀先产生 | |
| D. | 根据HClO的Ka=3.0×10-8,H2CO3的Ka1=4.3×10-7,Ka2=5.6×10-11,可推测相同状况下,等浓度的NaClO与Na2CO3溶液中,pH前者小于后者 |
17.下列物质能跟镁粉反应,并有氢气放出的是( )
①醋酸溶液 ②福尔马林
③葡萄糖粉末共热 ④乙醚.
①醋酸溶液 ②福尔马林
③葡萄糖粉末共热 ④乙醚.
| A. | ①、② | B. | ①、④ | C. | ①、③ | D. | ②、④ |
1.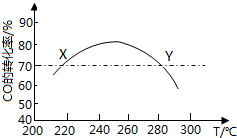 工业上,利用CO和H2合成二甲醚:3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)在合适的温度下,研究者进行了多次实验,每次实验保持原料气组成(3molCO、3molH2)、体积(10L)、反应时间等因素不变,实验结果如图所示.下列说法正确的是( )
工业上,利用CO和H2合成二甲醚:3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)在合适的温度下,研究者进行了多次实验,每次实验保持原料气组成(3molCO、3molH2)、体积(10L)、反应时间等因素不变,实验结果如图所示.下列说法正确的是( )
 工业上,利用CO和H2合成二甲醚:3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)在合适的温度下,研究者进行了多次实验,每次实验保持原料气组成(3molCO、3molH2)、体积(10L)、反应时间等因素不变,实验结果如图所示.下列说法正确的是( )
工业上,利用CO和H2合成二甲醚:3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)在合适的温度下,研究者进行了多次实验,每次实验保持原料气组成(3molCO、3molH2)、体积(10L)、反应时间等因素不变,实验结果如图所示.下列说法正确的是( )| A. | X、Y两点对应的CO正反应速率相等 | |
| B. | 合成二甲醚的正反应△H>0 | |
| C. | 反应温度应控制在240℃~260℃之间 | |
| D. | 选择合适催化剂,可以提高CO转化率 |
11.化学是一门实用性强的自然科学,在社会、生产、生活中起着重要的作用,下列说法不正确的是( )
| A. | 油条的制作口诀是“一碱、二矾、三钱盐”,其中的“碱”是烧碱 | |
| B. | 黑火药的最优化配方是“一硫二硝三木炭”,其中的“硝”是硝酸钾 | |
| C. | 过滤操作要领是“一贴二低三靠”,其中“贴”是指滤纸紧贴漏斗的内壁 | |
| D. | “固体需匙或纸槽,一送二竖三弹弹;块固还是镊子好,一横二放三慢竖“.前一个固体一般指粉末状固体 |
18. 常温下,向饱和氯水中逐滴滴入0.1mol•L-1的氢氧化钠溶液,pH变化如图所示,下列有关叙述正确的是( )
常温下,向饱和氯水中逐滴滴入0.1mol•L-1的氢氧化钠溶液,pH变化如图所示,下列有关叙述正确的是( )
 常温下,向饱和氯水中逐滴滴入0.1mol•L-1的氢氧化钠溶液,pH变化如图所示,下列有关叙述正确的是( )
常温下,向饱和氯水中逐滴滴入0.1mol•L-1的氢氧化钠溶液,pH变化如图所示,下列有关叙述正确的是( )| A. | ①点所示溶液中只存在HCl0的电离平衡 | |
| B. | ②到③的过程中水的电离程度一定减少 | |
| C. | ②点处表示氯气与氢氧化钠溶液恰好反应完全 | |
| D. | ②点所示溶液中:c( Na+)=c(HCl0)+2c(ClO -) |
15.向27.2g由Cu和Cu2O组成的混合物中加入0.5L某浓度的稀硝酸,混合物完全溶解,生成NO和Cu(NO3)2,向所得溶液中加入1L1.0mol•L-1NaOH溶液,恰好使Cu2+沉淀完全,沉淀经洗涤、充分灼烧后得32.0g固体.若忽略溶液的体积变化,则下列判断不正确的是( )
| A. | Cu和Cu2O的物质的量之比为2:1 | |
| B. | 产生的NO在标准状况下的体积为4.48L | |
| C. | 硝酸的物质的量浓度为2.6mol•L-1 | |
| D. | Cu和Cu2O与硝酸反应后剩余HNO3为0.2mol |
