题目内容
20.某探究小组用KMnO4酸性溶液与H2C2O4溶液反应过程中溶液紫色消失快慢的方法,研究影响反应速率的因素.实验条件作如下限定:所用酸性KMnO4溶液的浓度可选择0.010mol•L-1、0.0010mol•L-1,催化剂的用量可选择0.5g、0g,实验温度可选择298K、323K.每次实验KMnO4酸性溶液的用量均为4mL、H2C2O4溶液(0.10mol•L-1)的用量均为2mL.
(1)已知草酸溶液中各种微粒存在形式的分布曲线图如图1,请写出KMnO4酸性溶液与H2C2O4溶液反应的离子方程式2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.
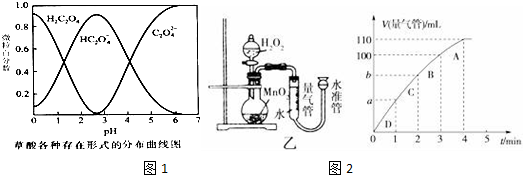
(2)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
| 实验编号 | T/K | 催化剂的用量/g | 酸性KMnO4溶液的浓度/mol•L-1 | 实验目的 |
| ① | 298 | 0.5 | 0.010 | a.实验①和②探究酸性KMnO4溶液的浓度对该反应速率的影响; b.实验①和③ 探究温度对反应速率的影响; c.实验①和④ 探究催化剂对反应速率的影响. |
| ② | ||||
| ③ | 0.010 | |||
| ④ |
| 实验编号 | 溶液褪色所需时间 t/min | ||
| 第1次 | 第2次 | 第3次 | |
| Ⅰ | 14.0 | 13.0 | 11.0 |
| Ⅱ | 6.5 | 6.7 | 6.8 |
②该同学分析上述数据后得出“当其他条件相同的情况下,酸性KMnO4溶液的浓度越小,所需要的时间就越短,亦即其反应速率越快”的结论,你认为是否正确否(填“是”或“否”).他认为不用经过计算,直接根据表中褪色时间的长短就可以判断浓度大小与反应速率的关系,你认为是否可行否(填“是”或“否”),若不可行(若认为可行则不填),请设计可以直接通过观察褪色时间的长短来判断的改进方案:取过量的体积相同、浓度不同的草酸溶液,分别同时与体积相同、浓度相同的酸性高锰酸钾溶液反应
(4)该反应的催化剂选择MnCl2还是MnSO4并简述选择的理由:MnSO4,如选用MnCl2,则酸性高锰酸钾会与Cl-反应,而且引入了Cl-无法证明是Mn2+起了催化作用
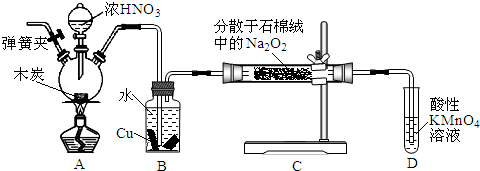
(5)化学催化剂有很多,在生产和科技领域起到重大作用.探究小组又利用乙装置探究MnO2对H2O2分解的催化效果.将50mL H2O2一次性加入盛有0.10mol MnO2粉末的烧瓶中,测得标准状况下由量气管读出气体的体积[V(量气管)/mL]和时间(t/min)的关系如图2所示.
①实验时放出气体的总体积是110mL.
②b小于(填“大于”“小于”或“等于”)90mL.
分析 (1)酸性高锰酸钾溶液具有强氧化性,能氧化草酸根离子生成二氧化碳,同时自身被还原生成二价锰离子,根据氧化还原反应得失电子守恒配平反应方程式;
(2)根据实验的目的和影响化学反应速率的因素来设计实验;
(3)①根据0.01KMnO4酸性溶液前后三次褪色时间差距较大,应舍去,所以用0.001KMnO4酸性溶液三次褪色来计算:先求出反应开始时c(KMnO4),然后求出三次褪色的平均时间,最后根据ν(KMnO4)=$\frac{△c}{△t}$进行计算;
②根据KMnO4的物质的量不同来分析;
(4)酸性条件下,高锰酸根离子能将氯离子氧化成氯气;
(5)①根据图象确定生成氧气的体积;
②图象斜率的大小反映反应速率快慢,斜率越大,反应速率越快,将50mL H2O2一次性加入盛有0.10mol MnO2粉末的烧瓶中,由于反应物浓度减小,反应速率减小,3min~4min生成10mL气体,那么2min~3min生成气体的体积应大于10mL,故b小于90mL.
解答 解:(1)酸性高锰酸钾溶液具有强氧化性,能氧化草酸根离子生成二氧化碳,同时自身被还原生成二价锰离子,离子反应为5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O,
故答案为:5H2C2O4+2MnO4-+6H+=1OCO2↑+2Mn2++8H2O;
(2)由实验目的可知,探究浓度、温度、接触面积对化学反应速率的影响,
实验①和②探究KMnO4酸性溶液的浓度对反应速率的影响,则实验①②的温度、催化剂的用量相同,只有浓度不同;实验①③的温度不同,则实验目的是探究温度对化学反应速率的影响,则①③中只有温度不同,其他条件相同;实验①④应该是探究催化剂对反应速率的影响,则①④中只有催化剂的用量不同,其他条件相同,据此完成表格为:
| 实验 编号 | T/K | 催化剂的用量/g | 酸性KMnO4溶液的浓度/mol•L-1 | 实验目的 |
| ① | b.③ c.④ | |||
| ② | 298 | 0.5 | 0.0010 | |
| ③ | 323 | 0.5 | ||
| ④ | 298 | 0 | 0.010 |
| 实验 编号 | T/K | 催化剂的用量/g | 酸性KMnO4溶液的浓度/mol•L-1 | 实验目的 |
| ① | b.③ c.④ | |||
| ② | 298 | 0.5 | 0.0010 | |
| ③ | 323 | 0.5 | ||
| ④ | 298 | 0 | 0.010 |
(3)①反应开始时:c(KMnO4)=$\frac{0.001mol/L×0.004L}{0.004L+0.002L}$=0.00067 mol•L-1
反应时间:△t=$\frac{6.5min+6.7min+6.8min}{3}$=6.7min
KMnO4的平均反应速率:ν(KMnO4)=$\frac{0.00067mol/L}{6.7min}$=1×10-4 mol•L-1•min-1,
故答案:1×10-4 mol•L-1•min-1;
②从表中数据可知,相同体积的0.01mol/LKMnO4酸性溶液是0.001mol/LKMnO4酸性溶液10倍,但反应的时间却比其反应时间的二倍左右,由反应速率计算公式(v=$\frac{△c}{△t}$)可得出,此实验条件下KMnO4酸性溶液的浓度越大反应速率越快;因根据直接看表中的褪色时间长短来判断浓度大小与反应速率的关系,需满足高锰酸钾的物质的量相同,浓度不同的草酸溶液;
故答案为:否;否;取过量的体积相同、浓度不同的草酸溶液,分别同时与体积相同、浓度相同的酸性高锰酸钾溶液反应;
(4)酸性条件下,高锰酸根离子能将氯离子氧化成氯气,自身被还原成二价锰离子,反应方程式为2MnO4-+10Cl-+16H+=5Cl2↑+2Mn2++8H2O,
故答案为:MnSO4,如选用MnCl2,则酸性高锰酸钾会与Cl-反应,而且引入了Cl-无法证明是Mn2+起了催化作用;
(5)①根据图象知,第4分钟时,随着时间的推移,气体体积不变,所以实验时放出气体的总体积是110 mL,
故答案为:110;
②图象斜率的大小反映反应速率快慢,斜率越大,反应速率越快,将50mL H2O2一次性加入盛有0.10mol MnO2粉末的烧瓶中,由于反应物浓度减小,反应速率减小,3min~4min生成10mL气体,那么2min~3min生成气体的体积应大于10mL,故b小于90mL,
故答案为:小于.
点评 本题主要结合实验考查了外界条件对化学反应速率的影响,反应速率的计算,培养了学生分析问题、解决问题的能力.

 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案| A. | 铝制容器可以贮运浓硝酸 | B. | 甲醛可用作浸制标本 | ||
| C. | 碳酸氢钠可用来治疗胃酸过多 | D. | 明矾可用作消毒剂 |
| A. | FeSO4、Fe(NO3)3; Fe2(SO4)3、HNO3、N2O、H2O | |
| B. | HNO3、FeSO4; Fe2(SO4)3、Fe(NO3)3、N2O、H2O | |
| C. | HNO3、Fe2(SO4)3; FeSO4、Fe(NO3)3、N2O、H2O | |
| D. | Fe2(SO4)3、N2O; FeSO4、HNO3、Fe(NO3)3、H2O |
| A. | 明矾既可用于净水,又可杀菌消毒 | |
| B. | 洁厕剂和漂白精不能混合使用,否则易产生有毒气体 | |
| C. | 双氧水可用于杀菌、消毒、漂白 | |
| D. | 家中发生天然气泄漏,不能在室内用电话报警 |
| A. | 明矾净水 | B. | 工业固氮 | C. | 海水提镁 | D. | 电池充电 |
 某兴趣小组同学利用氧化还原反应:2KMnO4+10FeSO4+8H2SO4=2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计如下原电池,盐桥中装有饱和溶液.下列说法正确的是( )
某兴趣小组同学利用氧化还原反应:2KMnO4+10FeSO4+8H2SO4=2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计如下原电池,盐桥中装有饱和溶液.下列说法正确的是( )| A. | a电极上发生的反应为:MnO4-+8H++5e-═Mn2++4H2O | |
| B. | 外电路电子的流向是从a到b | |
| C. | 电池工作时,盐桥中的SO42-移向甲烧杯 | |
| D. | b电极上发生还原反应 |
 .
.