题目内容
9.下列说法中不正确的是( )| A. | Na2CO3比NaHCO3易溶于水 | |
| B. | Na2CO3比NaHCO3稳定 | |
| C. | Na2CO3溶液比NaHCO3溶液碱性强 | |
| D. | 碳酸钠与盐酸反应放出二氧化碳的剧烈程度强于碳酸氢钠 |
分析 NaHCO3不稳定,溶解度比Na2CO3小,与盐酸反应较Na2CO3剧烈,可与NaOH反应生成Na2CO3,Na2CO3可与水、二氧化碳反应生成NaHCO3,以此解答该题.
解答 解:A.相同的温度下,NaHCO3溶解度比Na2CO3小,则Na2CO3比NaHCO3易溶于水,故A正确;
B.因2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,而碳酸钠加热不分解,故B正确;
C.Na2CO3的水解程度大于NaHCO3,所以Na2CO3溶液比NaHCO3溶液碱性强,故C正确;
D.NaHCO3的摩尔质量比Na2CO3的摩尔质量小,则与盐酸反应得到等质量CO2,用NaHCO3质量比Na2CO3要少,故D错误,
故选D.
点评 本题考查碳酸钠与碳酸氢钠的性质,明确发生的化学反应是解答本题的关键,并注意利用稳定性、与酸的反应、水解、与碱的反应来分析解答.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
5.化学知识在生产和生活中有着重要的应用.下列说法错误的是 (?)
| A. | 明矾既可用于净水,又可杀菌消毒 | |
| B. | 洁厕剂和漂白精不能混合使用,否则易产生有毒气体 | |
| C. | 双氧水可用于杀菌、消毒、漂白 | |
| D. | 家中发生天然气泄漏,不能在室内用电话报警 |
20.下列研究物质的实验方法有错误的一组是( )
| A. | 可用灼烧的方法区别丝绸与棉布 | |
| B. | 可用焰色反应区别硫酸钠和硫酸钾 | |
| C. | 可用结晶的方法分离乙酸(沸点118℃)和乙酸乙酯(沸点77.1℃) | |
| D. | 可用分液的方法分离汽油和水 |
4. 某兴趣小组同学利用氧化还原反应:2KMnO4+10FeSO4+8H2SO4=2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计如下原电池,盐桥中装有饱和溶液.下列说法正确的是( )
某兴趣小组同学利用氧化还原反应:2KMnO4+10FeSO4+8H2SO4=2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计如下原电池,盐桥中装有饱和溶液.下列说法正确的是( )
 某兴趣小组同学利用氧化还原反应:2KMnO4+10FeSO4+8H2SO4=2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计如下原电池,盐桥中装有饱和溶液.下列说法正确的是( )
某兴趣小组同学利用氧化还原反应:2KMnO4+10FeSO4+8H2SO4=2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计如下原电池,盐桥中装有饱和溶液.下列说法正确的是( )| A. | a电极上发生的反应为:MnO4-+8H++5e-═Mn2++4H2O | |
| B. | 外电路电子的流向是从a到b | |
| C. | 电池工作时,盐桥中的SO42-移向甲烧杯 | |
| D. | b电极上发生还原反应 |
14.某电解池内盛有CuSO4溶液,插入两根电极,接通直流电源后,欲达到如下要求:①阳极质量不变 ②阴极质量增加 ③电解液pH减小,则应选用的电极是( )
| A. | 阴阳两极都是石墨 | B. | 铜作阳极,铁作阴极 | ||
| C. | 铁作阳极,铜作阴极 | D. | 铜作阳极,铂作阴极 |
1.下列有关实验的描述正确的是( )
| A. | 常温下,用pH计测定0.1mol/L的甲酸钠溶液pH为13 | |
| B. | 向饱和醋酸钠溶液中添加0.1mol/L的碳酸钠溶液产生了无色气体 | |
| C. | 少量Mg(OH)2沉淀中加入氯化铵浓溶液可以观其察到白色沉淀溶解 | |
| D. | 向2ml 1mol/L的NaOH溶液中加入3滴 1mol/L MgCl2溶液,再加入3 滴1mol/L FeCl3溶液可以证明Mg(OH)2沉淀转变成Fe(OH)3沉淀 |
18.某学生对SO2与漂粉精的反应进行实验探究:
(1)向水中持续通入SO2,未观察到白雾.推测现象i的白雾由HCl小液滴形成,进行如下实验:
a.用湿润的碘化钾淀粉试纸检验白雾,无变化;
b.用酸化的AgNO3溶液检验白雾,产生白色沉淀.
①实验a目的是检验白雾中是否含有Cl2,排除Cl2干扰;
②由实验a、b不能判断白雾中含有HCl,理由是白雾中混有SO2,SO2可与酸化的AgNO3反应产生白色沉淀;
(2)现象ⅱ中溶液变为黄绿色的可能原因:随溶液酸性的增强,漂粉精的有效成分和Cl-发生反应.通过进一步实验确认了这种可能性,其实验方案是向漂粉精溶液中逐滴加入硫酸,观察溶液是否变为黄绿色;
(3)将A瓶中混合物过滤、洗涤,得到沉淀X.
①向沉淀X中加入稀HCl,无明显变化.取上层清液,加入BaCl2溶液,产生白色沉淀.则沉淀X中含有的物质是CaSO4;
②用离子方程式解释现象ⅲ中黄绿色褪去的原因SO2+Cl2+2H2O=SO42-+2Cl-+4H+.
| 操作 | 现象 |
| 取4g漂粉精固体,加入100mL水 | 部分固体溶解,溶液略有颜色 |
| 过滤,测漂粉精溶液的pH | pH试纸先变蓝(约为12),后褪色 |
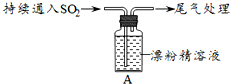 | i.液面上方出现白雾; ⅱ.稍后,出现浑浊,溶液变为黄绿色; ⅲ.稍后,产生大量白色沉淀,黄绿色褪去 |
a.用湿润的碘化钾淀粉试纸检验白雾,无变化;
b.用酸化的AgNO3溶液检验白雾,产生白色沉淀.
①实验a目的是检验白雾中是否含有Cl2,排除Cl2干扰;
②由实验a、b不能判断白雾中含有HCl,理由是白雾中混有SO2,SO2可与酸化的AgNO3反应产生白色沉淀;
(2)现象ⅱ中溶液变为黄绿色的可能原因:随溶液酸性的增强,漂粉精的有效成分和Cl-发生反应.通过进一步实验确认了这种可能性,其实验方案是向漂粉精溶液中逐滴加入硫酸,观察溶液是否变为黄绿色;
(3)将A瓶中混合物过滤、洗涤,得到沉淀X.
①向沉淀X中加入稀HCl,无明显变化.取上层清液,加入BaCl2溶液,产生白色沉淀.则沉淀X中含有的物质是CaSO4;
②用离子方程式解释现象ⅲ中黄绿色褪去的原因SO2+Cl2+2H2O=SO42-+2Cl-+4H+.
19.某小组设计电解饱和食盐水的装置如图,通电后两极均有气泡产生且溶液不变蓝,下列叙述正确的是( )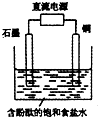

| A. | 铜电极上发生还原反应 | B. | 石墨电极附近溶液呈红色 | ||
| C. | 溶液中的Na+向石墨电极移动 | D. | 铜电极附近观察到黄绿色气体 |
