题目内容
16.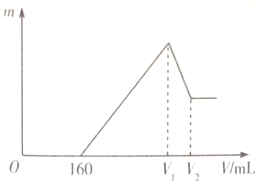 将0.1mol的Mg、Al混合物溶于100mL2mo L•L-1稀硫酸中,然后再滴加1moL•L-1 NaOH溶液.若在滴加NaOH溶液的过程中,沉淀质量(随加入NaOH溶液的体积(V)变化如图所示,当开始出现沉淀(不考虑混合时溶液体积的变化)下列判断正确的是( )
将0.1mol的Mg、Al混合物溶于100mL2mo L•L-1稀硫酸中,然后再滴加1moL•L-1 NaOH溶液.若在滴加NaOH溶液的过程中,沉淀质量(随加入NaOH溶液的体积(V)变化如图所示,当开始出现沉淀(不考虑混合时溶液体积的变化)下列判断正确的是( )| A. | Mg与Al的质量比为3:2 | B. | (V1-160):(V2-V1)=3:1 | ||
| C. | 沉淀质量m最大=3.48 g | D. | V1时:c(Na+)=$\frac{400}{100+{V}_{1}}$mol•L-1 |
分析 镁铝的混合物溶于稀硫酸溶液中,发生反应生成硫酸镁和硫酸铝,然后再滴入氢氧化钠溶液,氢氧化钠体积小于160ml时,和没有反应的硫酸反应,故0~160ml时,不产生沉淀,氢氧化钠体积为160ml~v1时,硫酸镁和硫酸铝和氢氧化钠反应生成氢氧化镁和氢氧化铝,氢氧化钠体积为v1~v2时氢氧化铝和氢氧化钠反应,生成偏铝酸钠,当氢氧化钠体积为v1时,镁离子和铝离子恰好沉淀,溶液中阳离子为Na+,阴离子为SO42-,即溶液中的溶质为Na2SO4,n(Na+)=2n(SO42-),其中Na+来自NaOH,SO42-来自H2SO4,故当氢氧化钠体积为v1时,n(NaOH)=2n(H2SO4),据此进行分析.
解答 解:A.设0.1mol镁铝的混合物中镁、铝的物质的量分别为x和y,x+y=0.1mol①,
氢氧化钠体积小于160ml时不产生沉淀,此时氢氧化钠和没有反应的硫酸反应,和硫酸反应的氢氧化钠物质的量=0.16L×1mol•L-1=0.16mol,
2NaOH+H2SO4=Na2SO4+2H2O
0.16mol 0.08mol
镁铝和硫酸反应,消耗的硫酸应该为:0.1L×2mol•L-1-0.08mol=0.12mol
发生的反应分别为:Mg+H2SO4=MgSO4+H2,2Al+3H2SO4=Al2(SO4)3+3H2,
1 1 2 3
x x y $\frac{3y}{2}$
则:x+$\frac{3y}{2}$=0.12mol②
由式①②可得x=0.06mol,y=0.04mol,故n(Mg)=0.06mol,n(Al)=0.04mol,则m(Mg)=0.06mol×24g/mol=1.44g,n(Al)=0.04mol×27g/mol=1.08g,故m(Mg):n(Al)=1.44g:1.08g=4:3;故A错误;
B.当氢氧化钠体积为v1时,镁离子和铝离子恰好沉淀,溶液中阳离子为Na+,阴离子为SO42-,即溶液中的溶质为Na2SO4,n(Na+)=2n(SO42-),其中Na+来自NaOH,SO42-来自H2SO4,故当氢氧化钠体积为v1时,n(NaOH)=2n(H2SO4)=2×2mol•L-1×0.1L=0.4mol,v(NaOH)=$\frac{n(NaOH)}{c(NaOH)}$=$\frac{0.4mol}{1mol•{L}^{-1}}$=0.4L=400ml,故v1=400ml,由A得,氢氧化钠体积为v1时生成Mg(OH)2和Al(OH)3物质的量分别0.06mol和0.04mol,
氢氧化钠体积为v1~v2时氢氧化铝和氢氧化钠反应,生成偏铝酸钠,Al(OH)3 +NaOH=NaAlO2+2H2O,
0.04mol 0.04mol,Al(OH)3 和NaOH反应消耗NaOH0.04mol,v(NaOH)=$\frac{n(NaOH)}{c(NaOH)}$=$\frac{0.04mol}{1mol•{L}^{-1}}$=0.04L=40ml,即:v1~v2时氢氧化钠为40ml,0~v1消耗400ml氢氧化钠,V2=440 mL,故(V1-160):(V2-V1)=(400-160):(440-400)=6:1,
故B错误;
C.Mg~~Mg(OH)2 ; Al~~Al(OH)3;
0.06mol 0.06mol 0.04mol 0.04mol
在滴加NaOH溶液的过程中,产生沉淀的质量m=m(Mg(OH)2 )+m(Al(OH)3)=0.06mol×58g/mol+0.04mol×78g/mol=6.6g,故C错误;
D.V1时:c(Na+)=$\frac{n(N{a}^{+})}{V}$=$\frac{0.4L×1mol/L}{0.1L+0.4L}$=0.8mol•L-1,而$\frac{400}{100+{V}_{1}}$mol•L-1=$\frac{400}{100+400}$mol•L-1=0.8mol•L-1,故V1时:c(Na+)=$\frac{400}{100+{V}_{1}}$mol•L-1,故D正确;
故选D.
点评 本题考查镁铝化合物性质、混合物的计算,以图象题的形式考查,题目难度中等,分析图象各阶段的发生的反应是解题关键,

 阅读快车系列答案
阅读快车系列答案| A. | 0.1L含24.5gH2SO4的溶液 | B. | 0.5L含49gH2SO4的溶液 | ||
| C. | 98gH2SO4溶于水配成2 L溶液 | D. | 1LH2SO4溶液中含98gH2SO4 |
| A. | 2,2,3,3一四甲基丁烷 | B. | 2,3,4一三甲基戊烷 | ||
| C. | 3,4一二乙基己烷 | D. | 2,2一二甲基己烷 |
| 实验次数 | 混合物的质量/g | 所加Ba(OH)2溶液的体积/L | 测得沉淀的质量/g |
| 1 | 0.858 | 0.5 | 1.379 |
| 2 | 1.716 | 0.5 | |
| 3 | 2.574 | 0.5 | 4.137 |
| 4 | 3.432 | 0.5 | 5.516 |
| 5 | 4.290 | 0.5 | 5.516 |
| 6 | 5.148 | 0.5 | 5.516 |
(1)第二次实验中产生沉淀的质量是2.758g;
(2)混合物中K2CO3和NaHCO3的物质的量之比为5:2.
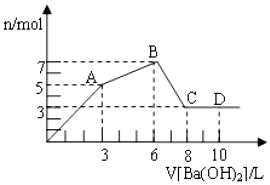 向含Al2(SO4)3和AlCl3的混合溶液中逐滴加入1mol/L Ba(OH)2溶液至过量,加入Ba(OH)2溶液的体积和所得沉淀的物质的量的关系如图,下列说法不正确的是( )
向含Al2(SO4)3和AlCl3的混合溶液中逐滴加入1mol/L Ba(OH)2溶液至过量,加入Ba(OH)2溶液的体积和所得沉淀的物质的量的关系如图,下列说法不正确的是( )| A. | 图中A点生成的沉淀是BaSO4和Al(OH)3 | |
| B. | 原混合液中c[Al2(SO4)3]:c(AlCl3)=1:2 | |
| C. | AB段反应的离子方程式为:3Ba2++2Al3++8OH-+3SO42-═BaSO4↓+2AlO2-+4H2O | |
| D. | 向D点溶液中通入CO2气体,立即产生白色沉淀 |
| A. | 22Ne的质子数为12 | B. | 20Ne和22Ne的中子数相同 | ||
| C. | 20Ne和22Ne的质量数相同 | D. | 20Ne和22Ne互为同位素 |
| A. | PM 2.5是指大气中直径小于或等于2.5微米的颗粒物,与肺癌、哮喘等疾病的发生密切相关,是造成雾霾天气的主要原因 | |
| B. | 海洋植物具有富集碘的能力,因此从海产品中提取碘是工业上获取碘的重要途径,工业上从海带中提取碘经历的步骤有:灼烧→浸泡→过滤→萃取→粗碘提纯 | |
| C. | 海水淡化的方法有蒸馏法、电渗析法等 | |
| D. | 用活性炭为糖浆脱色和用次氯酸盐漂白纸浆的原理不同 |
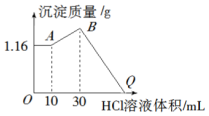 把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后有1.16g白色沉淀,在所得的浊液中逐滴加入1mol•L-1 HCl溶液,加入HCl溶液的体积与生成沉淀的质量关系如图所示.
把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后有1.16g白色沉淀,在所得的浊液中逐滴加入1mol•L-1 HCl溶液,加入HCl溶液的体积与生成沉淀的质量关系如图所示.