题目内容
19.将5克NaCl、NaBr、CaCl2的混合物溶于水,通入Cl2使充分反应;然后将溶液蒸干、灼烧,残留的物质为4.914克;将此残留物溶于水,并加入足量的Na2CO3.溶液,所得沉淀经干燥后其质量为0.27克.求原混合物中NaCl的质量分数.分析 根据题意可列出下图示,帮助审清题意,找出思路和解法. ,根据反应的关系式计算.
,根据反应的关系式计算.
解答 解:根据题意可列出下图示,
根据图示可分析:
CaCO3的质量为0.270g,由它可求出CaCl2的质量,
CaCl2-----------CaCO3
111 100
x 0.270g
x=$\frac{111×0.270g}{100}$=0.300g,
混合物中通入Cl2
2NaBr+Cl2=2NaCl+Br2~质量减小 206-117=89
206 89
y 5.000g-4.914g=0.086g
y=0.200g,
NaCl的质量=5.000-0.200-0.300=4.500(g),
各组分的百分含量:w(NaCl)=$\frac{4.500g}{5g}$×100%=90%,
答:原混合物中NaCl的质量分数为90%.
点评 本题考查混合物的计算,题目难度中等,注意根据反应的关系式计算.

练习册系列答案
 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案
相关题目
9.在一定条件下发生反应2A(g)═2B(g)+C(g),将2mol A通入2L容积恒定的密闭容器甲中,若维持容器内温度不变,5min末测得A的物质的量为0.8mol.用B的浓度变化来表示该反应的速率为( )
| A. | 0.24 mol/(L•min) | B. | 0.08 mol/(L•min) | C. | 0.06 mol/(L•min) | D. | 0.12 mol/(L•min) |
7.下列化合物的核磁共振氢谱中出现三组峰的是( )
| A. | 2,2,3,3一四甲基丁烷 | B. | 2,3,4一三甲基戊烷 | ||
| C. | 3,4一二乙基己烷 | D. | 2,2一二甲基己烷 |
14.下列物质溶于水时会破坏水的电离平衡,且属于电解质的是( )
| A. | 氯气 | B. | 氨气 | C. | 碘化钾 | D. | 碳酸氢钠 |
11.为了测定K2CO3和NaHCO3混合物的组成,某学生每次称取一定质量的混合物溶于水配成溶液,向其中加入相同浓度的Ba(OH)2溶液,每次实验均充分反应,实验结果记录如下
请回答下列问题:
(1)第二次实验中产生沉淀的质量是2.758g;
(2)混合物中K2CO3和NaHCO3的物质的量之比为5:2.
| 实验次数 | 混合物的质量/g | 所加Ba(OH)2溶液的体积/L | 测得沉淀的质量/g |
| 1 | 0.858 | 0.5 | 1.379 |
| 2 | 1.716 | 0.5 | |
| 3 | 2.574 | 0.5 | 4.137 |
| 4 | 3.432 | 0.5 | 5.516 |
| 5 | 4.290 | 0.5 | 5.516 |
| 6 | 5.148 | 0.5 | 5.516 |
(1)第二次实验中产生沉淀的质量是2.758g;
(2)混合物中K2CO3和NaHCO3的物质的量之比为5:2.
9.下列有关等电子体的说法正确的是( )
| A. | NO3-和CO32-是等电子体,均为平面三角形结构 | |
| B. | CH4和NH4+是等电子体,键角均为60° | |
| C. | H3O+和PC13是等电子体,均为三角锥形结构 | |
| D. | B3N3H6和苯是等电子体,B3N3H6分子中不存在“肩并肩”式重叠的轨道 |
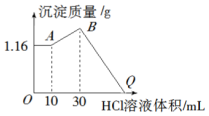 把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后有1.16g白色沉淀,在所得的浊液中逐滴加入1mol•L-1 HCl溶液,加入HCl溶液的体积与生成沉淀的质量关系如图所示.
把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后有1.16g白色沉淀,在所得的浊液中逐滴加入1mol•L-1 HCl溶液,加入HCl溶液的体积与生成沉淀的质量关系如图所示.