题目内容
 已知给煤炭加氢可发生反应:C(s)+2H2(g)?CH4(g).在VL的容器中投入amol碳(足量),同时通入2amolH2,控制条件使其发生上述反应,测得碳的平衡转化率随压强及温度的变化关系如下图所示.下列说法正确的是( )
已知给煤炭加氢可发生反应:C(s)+2H2(g)?CH4(g).在VL的容器中投入amol碳(足量),同时通入2amolH2,控制条件使其发生上述反应,测得碳的平衡转化率随压强及温度的变化关系如下图所示.下列说法正确的是( )| A、上述正反应为放热反应 | ||
| B、在4MPa、1200K时,图中X点v(H2)正>v(H2)逆 | ||
C、在5MPa、800K时,该反应的平衡常数为
| ||
| D、工业上维持6MPa1000K而不采用10MPa1000K,主要是因为前者碳的转化率高 |
考点:转化率随温度、压强的变化曲线
专题:化学平衡专题
分析:A、根据温度对化学平衡的移动的影响知识来回答;
B、根据X点反应的移动方向来确定正反应速率和逆反应速率的关系;
C、根据此点碳的转化率结合三行式进行计算即可;
D、根据压强对反应速率以及平衡的移动的影响并结合生产实际来回答判断.
B、根据X点反应的移动方向来确定正反应速率和逆反应速率的关系;
C、根据此点碳的转化率结合三行式进行计算即可;
D、根据压强对反应速率以及平衡的移动的影响并结合生产实际来回答判断.
解答:
解:A、由图观察,温度越高碳的平衡转化率越大,平衡正向移动,正反应为吸热反应,故A错误;
B、由图观察,X点是未平衡时,反应正向进行,正反应速率大于逆反应速率,故B正确;
C、在5MPa、800K时,此时碳转化率为50%,
C(s)+2H2(g)?CH4(g)
起始(mol)a 2a 0
变化(mol)0.5a a 0.5a
平衡(mol)0.5a a 0.5a
k=
=
,故C错误;
D、该选择的原因是两者转化率相差不大,但压强增大对设备要求高,能量需求大,故D错误.
故选:B.
B、由图观察,X点是未平衡时,反应正向进行,正反应速率大于逆反应速率,故B正确;
C、在5MPa、800K时,此时碳转化率为50%,
C(s)+2H2(g)?CH4(g)
起始(mol)a 2a 0
变化(mol)0.5a a 0.5a
平衡(mol)0.5a a 0.5a
k=
| ||
(
|
| 0.5V |
| a |
D、该选择的原因是两者转化率相差不大,但压强增大对设备要求高,能量需求大,故D错误.
故选:B.
点评:本题考查化学平衡有关问题,注意化学平衡状态的判断以及平衡常数的有关计算是解题的关键,难度中等.

练习册系列答案
相关题目
下列物质中,属于电解质的是( )
| A、NaOH | B、蔗糖 |
| C、稀盐酸 | D、NaCl溶液 |
下列有关化学用语正确的是( )
| A、聚丙烯的链节:-CH2-CH2-CH2- | ||
B、NH4Cl的电子式: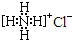 | ||
C、F-结构示意图: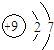 | ||
D、中子数为20的氯原子:
|
如图,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中,下列分析正确的是( )
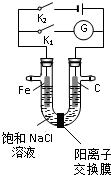

| A、K1闭合,铁棒侧溶液会出现白色沉淀,而且沉淀最终变为红褐色 |
| B、K1或K2闭合,石墨棒周围溶液pH均升高 |
| C、K2闭合,铁棒上发生的反应为2Cl--2e-=Cl2↑ |
| D、K2闭合,电路中通过0.002 NA个电子时,两极共产生0.002mol气体 |
现有铜质印刷线路板浸入200 mL氯化铁溶液中,有6.4g铜被腐蚀掉.取出印刷线路板,向溶液中加入5.6 g铁粉,经充分反应后,溶液中还存在3.2g不溶物.下列说法正确的是( )
| A、3.2 g不溶物为铁、铜混合物 |
| B、加铁粉之前,溶液中存在的金属阳离子有Cu2+、Fe3+ |
| C、加铁粉之前,溶液中的c(Cu2+):c(Fe2+)=1:1 |
| D、反应结束后溶液中的c(Fe2+)=2 mol?L-1 |

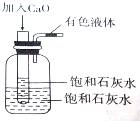 将一个装有饱和石灰水的试管放入盛有25℃饱和石灰水的广口瓶中,如图所示.
将一个装有饱和石灰水的试管放入盛有25℃饱和石灰水的广口瓶中,如图所示.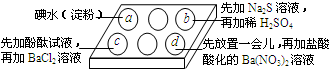 为探究Na2SO3溶液的性质,在白色点滴板的a、b、c、d四个凹槽中滴入Na2SO3 溶液,再分别滴加用如图所示的试剂对实验现象的“解释或结论”错误的是( )
为探究Na2SO3溶液的性质,在白色点滴板的a、b、c、d四个凹槽中滴入Na2SO3 溶液,再分别滴加用如图所示的试剂对实验现象的“解释或结论”错误的是( )