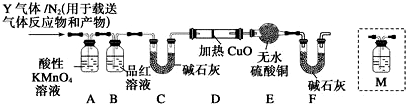
题目内容
14.在通常条件下,下列各组物质的性质排列正确的是( )| A. | 熔点:CO2>KCl>SiO2 | B. | 水溶性:HCl>H2S>SO2 | ||
| C. | 沸点:CH3OCH3>CH3CH2OH | D. | 热稳定性:HF>H2O>NH3 |
分析 A.晶体的熔点一般为原子晶体>离子晶体>金属晶体>分子晶体;
B.二氧化硫水溶性强于硫化氢,弱于氯化氢;
C.乙醇中存在氢键;
D.元素的非金属性越强,对应的氢化物越稳定.
解答 解:A.晶体的熔点一般为原子晶体>离子晶体>金属晶体>分子晶体,则熔点为SiO2>KCl>CO2,故错误;
B.水溶性:HCl>SO2>H2S,故B错误;
C.乙醇中存在氢键,沸点高于甲醚,故C错误;
D.非金属性F>O>N,元素的非金属性越强,对应的氢化物越稳定,HF>H2O>NH3,故D正确;
故选:D.
点评 本题考查元素周期表和元素周期律的应用,把握元素的位置、性质的变化规律为解答的关键,注意不同晶体类型熔沸点高低规律、注意氢键对物质熔沸点、溶解性影响,题目难度不大.

练习册系列答案
 天天向上口算本系列答案
天天向上口算本系列答案
相关题目
4.有某硫酸和硝酸的混合溶液20mL,其中含有硫酸的浓度为2mol•L-1,含有硝酸的浓度为1mol•L-1,现向其中加入0.96g铜粉,充分反应后(假设只生成NO气体),最多可收集到标准状况下的气体的体积为( )
| A. | 89.6 mL | B. | 112 mL | C. | 168 mL | D. | 224 mL |
5.已知常温下,在溶液中可发生如下反应:Ce4++Fe2+═Fe3++Ce3+,Sn2++2Fe3+═2Fe2++Sn4+.由此推断Fe2+、Ce3+、Sn2+的还原性由强到弱的顺序是( )
| A. | Sn2+、Fe2+、Ce3+ | B. | Fe2+、Ce3+、Sn2+ | C. | Fe2+、Sn2+、Ce3+ | D. | Ce3+、Fe2+、Sn2+ |
9.下列各组离子在指定条件下,一定不能大量共存的是( )
| A. | 加入Al能放出H2的溶液中:K+、Na+、CO32-、NO3- | |
| B. | 滴入甲基橙变黄的溶液中:Cu2+、Al3+、SO42-、NO3- | |
| C. | 能使碘化钾淀粉试纸变蓝的溶液中:Na+、NH4+、S2-、Br- | |
| D. | 水电离出的c(H+)=1×10-12 mol•L-1的溶液中:Na+、Mg2+、Cl-、SO42- |
19.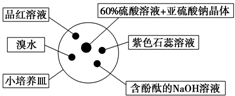 如图是研究二氧化硫性质的微型实验装置.现用60%硫酸溶液和亚硫酸钠晶体反应制取SO2气体,实验现象很明显,且不易污染空气.下列说法中错误的是( )
如图是研究二氧化硫性质的微型实验装置.现用60%硫酸溶液和亚硫酸钠晶体反应制取SO2气体,实验现象很明显,且不易污染空气.下列说法中错误的是( )
 如图是研究二氧化硫性质的微型实验装置.现用60%硫酸溶液和亚硫酸钠晶体反应制取SO2气体,实验现象很明显,且不易污染空气.下列说法中错误的是( )
如图是研究二氧化硫性质的微型实验装置.现用60%硫酸溶液和亚硫酸钠晶体反应制取SO2气体,实验现象很明显,且不易污染空气.下列说法中错误的是( )| A. | 紫色石蕊溶液变蓝色 | B. | 品红溶液褪色 | ||
| C. | 溴水橙色褪去 | D. | 含酚酞的NaOH溶液红色变浅或褪色 |
6.下列物质中,既能跟盐酸反应,又能跟NaOH溶液反应的是( )
| A. | NaHCO3 | B. | Fe2O3 | C. | Al2O3 | D. | SiO2 |