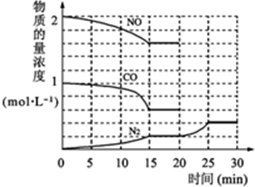
题目内容
下图所示的实验操作,不能达到相应目的是( )
A、 干燥Cl2 |
B、 检验K2CO3中的K+ |
C、 证明氨气极易溶于水 |
D、 实验室制氨气 |
考点:化学实验方案的评价
专题:实验评价题
分析:A.气体进出方向错误;
B.钾的焰色反应应透过蓝色钴玻璃观察;
C.根据气球的变化进行判断;
D.实验室可用氢氧化钙和氯化铵反应制备氨气.
B.钾的焰色反应应透过蓝色钴玻璃观察;
C.根据气球的变化进行判断;
D.实验室可用氢氧化钙和氯化铵反应制备氨气.
解答:
解:A.洗气时应长进短出,气体进出方向错误,故A错误;
B.钾的焰色反应应透过蓝色钴玻璃观察,易排除钠离子的干扰,故B正确;
C.如氨气极易溶于水,而烧瓶内压强减小,气球体积膨胀,故C正确;
D.实验室可用氢氧化钙和氯化铵反应制备氨气,氯化铵分解,在试管口又化合生成氯化铵,图中制备方法不合理,故D错误,
故选AD.
B.钾的焰色反应应透过蓝色钴玻璃观察,易排除钠离子的干扰,故B正确;
C.如氨气极易溶于水,而烧瓶内压强减小,气球体积膨胀,故C正确;
D.实验室可用氢氧化钙和氯化铵反应制备氨气,氯化铵分解,在试管口又化合生成氯化铵,图中制备方法不合理,故D错误,
故选AD.
点评:本题考查较为综合,涉及物质的分离、提纯、制备和检验等操作,为高考常见题型和高频考点,侧重于学生的分析能力和实验能力的考查,注意把握实验的严密性和可行性的评价,难度不大.

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目
设NA为阿伏加德罗常数,下列叙述中正确的是( )
| A、c(H+)=0.1mol/L的甲酸溶液中,HCOO-和H+数目之和为0.1NA |
| B、标准状况下,3.36L乙烯中含有的极性键数为0.60NA |
| C、1L 0.2mol/L的Fe2(SO4)3溶液中含0.4NA个Fe3+离子 |
| D、1mol油酸含有的双键数目约为NA |
X、Y、Z、W是原子序数依次增大的短周期主族元素,原子半径大小关系为:W>Y>Z>X.X与W同主族,Z原子核外电子总数是其内层电子总数的4倍,且Z原子的核电荷数等于X、Y原子核电荷数之和.下列说法正确的是( )
| A、元素Z、W的简单离子的半径:Z<W |
| B、元素Y、Z分别对应的简单气态氢化物M、N,沸点M<N,热稳定性M>N |
| C、仅由X、Y、Z三种元素形成的化合物的水溶液可能呈酸性,也可能呈碱性 |
| D、1mol X2Z2与1mol W2Z2所含共价键数目相等 |
下列反应的离子方程式书写正确的是( )
| A、等体积等物质的量浓度的氢氧化钡溶液与碳酸氢铵溶液混合:Ba2++2OH-+NH4++HCO3-═BaCO3↓+NH3?H2O+H2O |
| B、氢氧化铁溶于氢碘酸溶液:Fe(OH)3+3H+═Fe3++3H2O |
| C、能使pH试纸显深红色的溶液,Fe3+、Cl-、Ba2+、I-能大量共存 |
| D、已知电离平衡常数:H2CO3>HClO>HCO3-,向NaClO溶液中通入少量CO2的离子方程式:2ClO-+CO2+H2O═2HClO+CO32- |
分类法是人们认识事物时常用的科学方法.下列关于“Na2CO3”分类的说法错误的是( )
| A、属于钠盐 |
| B、属于电解质 |
| C、属于离子化合物 |
| D、属于氧化物 |
下列实验方案正确且能达到相应实验预期目的是( )
A、 配置一定物质的量浓度的硫酸溶液 |
B、 检验装置的气密性 |
C、 从碘水中分离碘单质 |
D、 探究碳酸氢钠的热稳定性 |
室温下,向10mL,pH=12的某碱溶液中加入10mL pH=2的盐酸,充分反应后滴入酚酞试液,溶液变红,则此碱一定是( )
| A、弱碱 | B、一元强碱 |
| C、多元强碱 | D、任何强碱 |