题目内容
环境问题备受世界关注.化工厂以及汽车尾气排放的一氧化碳(CO)、氮氧化物(NOx)、硫化物等气体己成为大气污染的主要因素.
(1)CO的中毒是由于CO与血液中血红蛋白的血红素部分反应生成碳氧血红蛋白,反应方程式可表示为:CO+Hb?O2?O2+Hb?CO.实验表明,c(Hb?CO)即使只有c(Hb?O2)的
,也可造成人的智力损伤.已知t℃时上述反应的平衡常数K=200,吸入肺部O2的浓度约为1.0×10-2mol?L-1,若使c(Hb?CO)小于c(Hb?O2)的
,则吸入肺部CO的浓度不能超过 mol?L-1.
(2)汽车尾气治理的方法之一是在汽车的排气管上安装一个“催化转化器”.已知反应2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-113kJ?mol-1
①为了模拟催化转化器的工作原理,在t℃时,将2molNO与1mol CO充入lL反应容器中,反应过程中NO(g)、CO(g)、N2(g)物质的量浓度变化如图.反应进行到15min时,NO的平均反应速率为 .
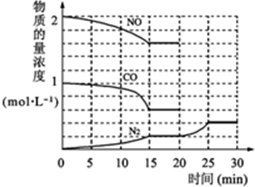
②观察在20min~30min内N2(g)发生变化的曲线图,判断引起该变化的条件可能是 ;
a.加入催化剂 b.降低体系温度
c.缩小容器体积为0.5L d.增加CO2的物质的量
(3)煤化工中常需研究不同温度下平衡常数、投料比及产率等问题.
已知:CO(g)+H2O(g)?H2(g)+CO2(g)的平衡常数随温度的变化如下表:
试回答下列问题
①上述正向反应是 反应(填“放热”、“吸热”),某温度下上述反应平衡时,恒容、升高温度,容器内混合气体的压强 (填“增大”、“减小”或“不变”).
②在830℃发生上述反应,以下表中的物质的量投入恒容反应器,其中向正反应方向移动的有 选填A、B、C、D).
(4)将燃煤废气中的CO2转化为甲醚的反应原理为:2CO2(g)+6H2(g)
CH3OCH3(g)+3H2O(g)
用甲醚作为燃料电池原料,在碱性介质中该电池负极的电极反应式 .若以4.48L?min-1(标准状况)的速率向该电池中通入甲醚(沸点为-24.9℃),用该电池电解100mL 2mol?L-1CuSO4溶液,通电0.5min后,理论上可析出金属铜 g.
(1)CO的中毒是由于CO与血液中血红蛋白的血红素部分反应生成碳氧血红蛋白,反应方程式可表示为:CO+Hb?O2?O2+Hb?CO.实验表明,c(Hb?CO)即使只有c(Hb?O2)的
| 1 |
| 50 |
| 1 |
| 50 |
(2)汽车尾气治理的方法之一是在汽车的排气管上安装一个“催化转化器”.已知反应2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-113kJ?mol-1
①为了模拟催化转化器的工作原理,在t℃时,将2molNO与1mol CO充入lL反应容器中,反应过程中NO(g)、CO(g)、N2(g)物质的量浓度变化如图.反应进行到15min时,NO的平均反应速率为

②观察在20min~30min内N2(g)发生变化的曲线图,判断引起该变化的条件可能是
a.加入催化剂 b.降低体系温度
c.缩小容器体积为0.5L d.增加CO2的物质的量
(3)煤化工中常需研究不同温度下平衡常数、投料比及产率等问题.
已知:CO(g)+H2O(g)?H2(g)+CO2(g)的平衡常数随温度的变化如下表:
| 温度/℃ | 400 | 500 | 830 | 1000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
①上述正向反应是
②在830℃发生上述反应,以下表中的物质的量投入恒容反应器,其中向正反应方向移动的有
| A | B | C | D | |
| n(CO2) | 3 | 1 | 0 | 1 |
| n(H2) | 2 | 1 | 0 | 1 |
| n(CO) | 1 | 2 | 3 | 0.5 |
| n(H2O) | 5 | 2 | 3 | 2 |
| 催化剂 |
用甲醚作为燃料电池原料,在碱性介质中该电池负极的电极反应式
考点:化学平衡的影响因素,化学电源新型电池,反应速率的定量表示方法
专题:化学平衡专题,电化学专题
分析:(1)根据平衡常数K=
=200代入公式计算;
(2)①根据V=
来计算;
②根据氮气的变化结合图象根据外界条件对化学平衡的影响来判断;
(3)①依据平衡常数随温度的变化结合平衡移动原理分析判断反应的热量变化,根据表中数据可知,温度升高平衡常数减小,说明平衡向逆反应方向移动,温度升高,反应速率增大,平衡向逆反应方向移动,压强增大;
②根据830℃时,平衡常数k=1,依据浓度计算和平衡常数比较判断;
(4)甲醚作为燃料电池的原料.甲醚在负极失电子发生氧化反应,依据电极书写方法写出电极反应;甲醚燃料电池为原电池做电源电解硫酸铜溶液,锌接原电池负极做阴极,依据电解原理,阳离子移向阴极,发生得电子的还原反应,结合电极反应电子守恒计算;
| c(O2)?c(Hb?CO) |
| c(CO)?c(Hb?O2) |
(2)①根据V=
| ||
| △t |
②根据氮气的变化结合图象根据外界条件对化学平衡的影响来判断;
(3)①依据平衡常数随温度的变化结合平衡移动原理分析判断反应的热量变化,根据表中数据可知,温度升高平衡常数减小,说明平衡向逆反应方向移动,温度升高,反应速率增大,平衡向逆反应方向移动,压强增大;
②根据830℃时,平衡常数k=1,依据浓度计算和平衡常数比较判断;
(4)甲醚作为燃料电池的原料.甲醚在负极失电子发生氧化反应,依据电极书写方法写出电极反应;甲醚燃料电池为原电池做电源电解硫酸铜溶液,锌接原电池负极做阴极,依据电解原理,阳离子移向阴极,发生得电子的还原反应,结合电极反应电子守恒计算;
解答:
解:(1)根据平衡常数K=
=200K,若使c(Hb?CO)小于c(Hb?O2)的 1/50,且吸入肺部O2的浓度约为1.0×10-2mol?L-1,则有
>200×50,则吸入肺部CO的浓度不能超过
=1.0×10-6mol?L-1,
故答案为:1.0×10-6;
(2)①由图象可知在15min内NO的物质的量变化0.4mol,则NO的平均反应速率为=
mol?L-1?min-1=0.027 mol?L-1?min-1,故答案为:0.027 mol?L-1?min-1;
②由图象可知,平衡向正反应方向移动,
a、加入催化剂,平衡不移动,故a错误;
b、降低温度,平衡向正反应方向移动,故b正确;
c、缩小容器体积,平衡向正反应方向移动,达平衡时,浓度应大于25min时的浓度,故c错误;
d、增加CO2的物质的量,平衡向逆反应方向移动,氮气的平衡浓度降低,故d错误.
故答案为b;
(3)1)根据表中数据可知,温度升高平衡常数减小,说明平衡向逆反应方向移动,则正反应放热,温度升高,反应速率增大,平衡向逆反应方向移动,反应前后气体体积不变,等容容器中压强之比等于温度之比,所以压强增大,故答案为:放热;增大;
(2)根据830℃时,平衡常数k=1计算;
A、Q=
>1,反应向逆反应方向移动,故A错误;
B、Q=
<1,反应向正反应方向移动,故B正确;
C、只有反应物,反应向正反应方向移动,故C正确;
D、Q=
=1.达到平衡状态,平衡不移动,故D错误.
故答案为:B、C.
(4)若用甲醚作为燃料电池的原料,甲醚在负极失电子反应氧化反应,在碱性介质中电池负极的电极反应式:CH3OCH3-12e-+16OH-=2CO32-+11H2O;
故答案为:CH3OCH3-12e-+16OH-=2CO32-+11H2O;
③甲醚燃料电池设计如图所示的装置,甲醚燃料电池为原电池做电源电解硫酸铜溶液,阴极电极反应为Cu2++2e-=Cu,通入甲醚(沸点为-24.9℃)的速率为4.48L?min-1(标准状况),则通电0.5min后消耗甲醚的物质的量是2.24L即0.1mol,根据反应CH3OCH3-12e-+16OH-=2CO32-+11H2O,这些甲醚伴随着1.2mol电子转移,阴极电极反应为Cu2++2e-=Cu,100mL2mol?L-1CuSO4溶液中铜离子的物质的量是0.2mol,只能转移电子0.4mol,当转移电子1.2mol时,析出金属铜的物质的量是0.2mol,质量是0.2mol×64g/mol=12.8g,
故答案为:12.8.
| c(O2)?c(Hb?CO) |
| c(CO)?c(Hb?O2) |
| c(O2) |
| c(CO) |
| 1.0×10-2mol/L |
| 10000 |
故答案为:1.0×10-6;
(2)①由图象可知在15min内NO的物质的量变化0.4mol,则NO的平均反应速率为=
| ||
| 15 |
②由图象可知,平衡向正反应方向移动,
a、加入催化剂,平衡不移动,故a错误;
b、降低温度,平衡向正反应方向移动,故b正确;
c、缩小容器体积,平衡向正反应方向移动,达平衡时,浓度应大于25min时的浓度,故c错误;
d、增加CO2的物质的量,平衡向逆反应方向移动,氮气的平衡浓度降低,故d错误.
故答案为b;
(3)1)根据表中数据可知,温度升高平衡常数减小,说明平衡向逆反应方向移动,则正反应放热,温度升高,反应速率增大,平衡向逆反应方向移动,反应前后气体体积不变,等容容器中压强之比等于温度之比,所以压强增大,故答案为:放热;增大;
(2)根据830℃时,平衡常数k=1计算;
A、Q=
| 2×3 |
| 5×1 |
B、Q=
| 1×1 |
| 0.5×2 |
C、只有反应物,反应向正反应方向移动,故C正确;
D、Q=
| 1×1 |
| 0.5×2 |
故答案为:B、C.
(4)若用甲醚作为燃料电池的原料,甲醚在负极失电子反应氧化反应,在碱性介质中电池负极的电极反应式:CH3OCH3-12e-+16OH-=2CO32-+11H2O;
故答案为:CH3OCH3-12e-+16OH-=2CO32-+11H2O;
③甲醚燃料电池设计如图所示的装置,甲醚燃料电池为原电池做电源电解硫酸铜溶液,阴极电极反应为Cu2++2e-=Cu,通入甲醚(沸点为-24.9℃)的速率为4.48L?min-1(标准状况),则通电0.5min后消耗甲醚的物质的量是2.24L即0.1mol,根据反应CH3OCH3-12e-+16OH-=2CO32-+11H2O,这些甲醚伴随着1.2mol电子转移,阴极电极反应为Cu2++2e-=Cu,100mL2mol?L-1CuSO4溶液中铜离子的物质的量是0.2mol,只能转移电子0.4mol,当转移电子1.2mol时,析出金属铜的物质的量是0.2mol,质量是0.2mol×64g/mol=12.8g,
故答案为:12.8.
点评:本题主要考查了平衡常数的计算、外界条件对平衡的影响、燃料电池的工作原理以及电子守恒的计算等知识,难度中等.

练习册系列答案
 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案
相关题目
下列金属在一定条件下能够与水反应,且生成金属氧化物的是( )
| A、K | B、Mg | C、Fe | D、Cu |
下图所示的实验操作,不能达到相应目的是( )
A、 干燥Cl2 |
B、 检验K2CO3中的K+ |
C、 证明氨气极易溶于水 |
D、 实验室制氨气 |



 )分子间脱水而得;一定条件下,M发生1个-OH的消去反应得到稳定化合物N(分子式为C6H8O2),则N的结构简式为
)分子间脱水而得;一定条件下,M发生1个-OH的消去反应得到稳定化合物N(分子式为C6H8O2),则N的结构简式为
 ).
). )发生类似反应①的反应,其生成物的结构简式为
)发生类似反应①的反应,其生成物的结构简式为
