题目内容
5.F2和Xe在一定条件下生成氧化性极强且极易与水反应的XeF2、XeF4和XeF6三种化合物.其中XeF4与H2O可以发生如下反应:6XeF4+12H2O═2XeO3+4Xe↑+24HF+3O2↑.下列判断正确的是( )| A. | 上述反应中氧化剂和还原剂的物质的量之比为l:2 | |
| B. | XeF4按以上方式与水反应,每生成3molO2转移12mol电子 | |
| C. | XeF2加入水中,在水分子的作用下,将重新生成Xe和F2 | |
| D. | XeF2、XeF4和XeF6在空气中都能长期存放 |
分析 A、根据得失电子数相等判断氧化剂和还原剂的物质的量之比;
B、6XeF4+12H2O═2XeO3+4Xe↑+24HF+3O2↑反应中,Xe元素化合价升高生成XeO3,降低生成Xe,O元素化合价升高,根据化合价降低的计算;
C、F2和水剧烈反应,不可能生成F2;
D、根据XeF4与H2O在常温下可以发生反应判断.
解答 解:A、6XeF4+12H2O═2XeO3+4Xe↑+24HF+3O2↑,该反应中,生成氙气的XeF4作氧化剂,生成XeO3的XeF4作还原剂,生成氧气的水作还原剂,所以该反应中4XeF4(氧化剂)+2XeF4(还原剂)+6H2O(还原剂)+6H2O═2XeO3+4Xe↑+24HF+3O2↑,氧化剂和还原剂的物质的量之比为4:(2+6)=1:2,故A正确;
B、由6XeF4+12H2O═2XeO3+4Xe↑+24HF+3O2↑可知,每生成3molO2即4molXe,转移电子为4mol×(4-0)=16mol,故B错误;
C、F2和水剧烈反应,不可能生成F2,故C错误;
D、因为XeF4与H2O在常温下可以发生反应,所以XeF4在空气中不能长期存放,故D错误.
故选A.
点评 本题考查了氧化还原反应的基本概念的判断以及有关计算等知识点,难度不大,注意A选项中部分XeF4做氧化剂部分XeF4作还原剂.

练习册系列答案
相关题目
15.一定条件下反应2AB(g)?A2(g)+B2(g)达到平衡状态的标志是( )
| A. | 单位时间内生成amolA2,同时消耗2a molAB | |
| B. | 容器内,3种气体AB、A2、B2共存 | |
| C. | 容器中各组分的体积分数不随时间变化 | |
| D. | AB的消耗速率等于A2的消耗速率 |
16.下列说法正确的是( )
| A. | KClO3和SO3溶于水后能导电,故KClO3和SO3为电解质 | |
| B. | 分别将CuSO4、Na2CO3、KNO3、FeCl3的饱和溶液加热、蒸发后,仍能得到与原物质组成相同的晶体只有CuSO4、KNO3 | |
| C. | 向NaAlO2溶液中滴加NaHCO3溶液,有沉淀和气体生成 | |
| D. | 浓度均为0.1 mol•L-1的NaClO溶液和CH3COONa溶液中:阴离子的总浓度前者小于后者 |
13.在标准状况下,VL氨气溶于水配成1L密度为ρg/cm3的氨水,该氨水的物质的量浓度为( )
| A. | $\frac{Vρ}{22400}$mol•L-1 | B. | $\frac{V}{22.4}$mol•L-1 | ||
| C. | $\frac{Vρ}{22400+17V}$mol•L-1 | D. | $\frac{1000Vρ}{22400+17V}$mol•L-1 |
20.向100g浓度为c mol•L-1,密度为ρ g•cm-3的食盐水中加入一定量的水,将其稀释至0.5c mol•L-1,则加入水的体积( )
| A. | 小于100 mL | B. | 等于100 mL | C. | 大于100 mL | D. | 等于100/ρ mL |
10.“PX”即对二甲苯,是一种可燃、低毒化合物,毒性略高于乙醇,其蒸汽与空气可形成爆炸性混合物,爆炸极限为1.1%~7.0%(体积分数),是一种用途极广的有机化工原料.下列关于“PX”的叙述不正确的是( )
| A. | “PX”的化学式为C8H10,核磁共振氢谱图上有2组吸收峰 | |
| B. | “PX”能使酸性高锰酸钾溶液褪色,属于苯的同系物 | |
| C. | “PX”的一溴代物和二溴代物的同分异构体分别有1种、3种 | |
| D. | “PX”不溶于水,密度比水小 |
17.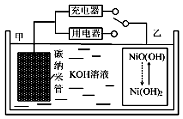 2016年8月,联合国开发计划署在中国的首个“氢经济示范城市”在江苏如皋落户.用吸附了H2的碳纳米管等材料制作的二次电池的原理如图所示.下列说法正确的是( )
2016年8月,联合国开发计划署在中国的首个“氢经济示范城市”在江苏如皋落户.用吸附了H2的碳纳米管等材料制作的二次电池的原理如图所示.下列说法正确的是( )
 2016年8月,联合国开发计划署在中国的首个“氢经济示范城市”在江苏如皋落户.用吸附了H2的碳纳米管等材料制作的二次电池的原理如图所示.下列说法正确的是( )
2016年8月,联合国开发计划署在中国的首个“氢经济示范城市”在江苏如皋落户.用吸附了H2的碳纳米管等材料制作的二次电池的原理如图所示.下列说法正确的是( )| A. | 放电时,甲电极反应为:NiO(OH)+H2O+e?═Ni(OH)2+OH? | |
| B. | 放电时,甲电极为正极,OH?移向乙电极 | |
| C. | 电池总反应为H2+2NiO(OH)$?_{放电}^{充电}$ 2Ni(OH)2 | |
| D. | 充电时,电池的碳电极与直流电源的正极相连 |
4.电子产品产生的大量电子垃圾对环境构成了极大的威胁.某化学兴趣小组将一批废弃的线路板简单处理后,得到含Cu、Al、Fe及少量Au、Pt等金属的混合物,并设计出如图制备硫酸铜和硫酸铝晶体的路线:
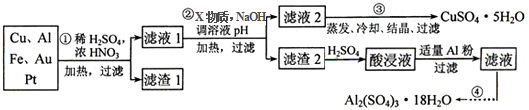
按要求回答下列问题:
(1)滤渣1中存在的金属有Au、Pt.
(2)已知沉淀物的pH如下表:
①则操作②中X物质最好选用的是d(填编号)
a.酸性高锰酸钾溶液 b.漂白粉 c.氯气 d.双氧水
②理论上应控制溶液pH的范围是4.4≤pH<4.9.
(3)检验滤液2中既不存在Fe2+又不存在Fe3+的操作步骤是①取少量滤液于试管中,②向其中加入少量KSCN溶液,如果溶液不变红证明不存在Fe3+,③继续向溶液中滴入新制的氯水,如果溶液不变红证明不存在Fe2+.
(4)用一个离子方程式表示在酸浸液中加入适量铝粉的反应:Al+Fe3+=Fe+Al3+.
(5)由CuSO4•5H2O制备CuSO4时,应把CuSO4•5H2O放在坩埚(填仪器名称)中加热脱水.
(6)现在某些电器中使用的高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压.高铁电池的总反应为 3Zn+2K2FeO4+8H2O$?_{充电}^{放电}$3Zn(OH)2+2Fe(OH)3+4KOH,该电池放电时负极反应式为Zn-2e-+2OH-=Zn(OH)2,每有1mol K2FeO4被还原,转移电子的物质的量为3mol,充电时阳极反应式为Fe(OH)3+5OH--3e-=FeO42-+4H2O.

按要求回答下列问题:
(1)滤渣1中存在的金属有Au、Pt.
(2)已知沉淀物的pH如下表:
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe2+ | 7.0 | 9.0 |
| Fe3+ | 1.9 | 3.7 |
| Cu2+ | 4.9 | 6.7 |
| Al3+ | 3.0 | 4.4 |
a.酸性高锰酸钾溶液 b.漂白粉 c.氯气 d.双氧水
②理论上应控制溶液pH的范围是4.4≤pH<4.9.
(3)检验滤液2中既不存在Fe2+又不存在Fe3+的操作步骤是①取少量滤液于试管中,②向其中加入少量KSCN溶液,如果溶液不变红证明不存在Fe3+,③继续向溶液中滴入新制的氯水,如果溶液不变红证明不存在Fe2+.
(4)用一个离子方程式表示在酸浸液中加入适量铝粉的反应:Al+Fe3+=Fe+Al3+.
(5)由CuSO4•5H2O制备CuSO4时,应把CuSO4•5H2O放在坩埚(填仪器名称)中加热脱水.
(6)现在某些电器中使用的高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压.高铁电池的总反应为 3Zn+2K2FeO4+8H2O$?_{充电}^{放电}$3Zn(OH)2+2Fe(OH)3+4KOH,该电池放电时负极反应式为Zn-2e-+2OH-=Zn(OH)2,每有1mol K2FeO4被还原,转移电子的物质的量为3mol,充电时阳极反应式为Fe(OH)3+5OH--3e-=FeO42-+4H2O.
5.下列关于1mol/L Na2SO4溶液的说法正确的是( )
| A. | 溶液中含有1molNa+ | |
| B. | 将142g Na2SO4溶于少量水后再稀释到 100mL | |
| C. | 1 mol Na2SO4溶于1 L蒸馏水中 | |
| D. | 1 L溶液中含有142 g Na2SO4 |