题目内容
12. 在某温度下、容积均为2L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2H2(g)+CO(g)?CH3OH(g)△H=-dkJ•mol-1(d>0).初始投料与各容器达到平衡时的有关数据如表:
在某温度下、容积均为2L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2H2(g)+CO(g)?CH3OH(g)△H=-dkJ•mol-1(d>0).初始投料与各容器达到平衡时的有关数据如表:| 实验 | 甲 | 乙 | 丙 |
| 初始投料 | 2mol H2、1mol CO | 1mol CH3OH | 4mol H2、2mol CO |
| 平衡时n(CH3OH) | 0.5mol | n2 | n3 |
| 反应的能量变化 | 放出Q1KJ | 吸收Q2KJ | 放出Q3KJ |
| 体系的压强 | P1 | P2 | P3 |
| 反应物的转化率 | α1 | α2 | α3 |
(2)三个容器中的反应分别达平衡时各组数据关系正确的是AB
A.α1+α2=1 B.Q1+Q2=d C.α3<α1
D.P3>2P1=2P2 E.n2<n3<1.0mol F.Q3<2Q1
(3)在其他条件不变的情况下,在第5min 时将甲容器的体系体积压缩到1L,若在第8min达到新的平衡,从0min开始到新平衡时H2的转化率为65.5%,请在图中画出第5min到新平衡时CH3OH的物质的量浓度的变化曲线.
分析 (1)发生反应:CO(g)+2H2(g)?CH3OH(g),利用三段式计算平衡时各组分的平衡浓度,代入平衡常数表达式计算平衡常数;
(2)A.甲、乙为等效平衡,平衡时CO的物质的量相等,令平衡时CO为amol,表示出甲中CO转化率、乙中甲醇的转化率,据此计算判断;
B.甲、乙为等效平衡,平衡时CO的物质的量相等,令平衡时CO为bmol,根据热化学方程式表示出甲中放出热量Q1、乙中吸收的热量Q2,据此计算判断;
C.丙与甲相比,可以等效为在甲的基础上,压强增大一倍;
D.甲、乙为等效平衡,平衡时对应各组分的物质的量相等,二者压强等效,丙与甲相比,可以等效为在甲的基础上,压强增大一倍,平衡向正反应移动,平衡时混合气体的物质的量小于甲中的2倍;
E.结合D中的分析解答;
F.丙与甲相比,可以等效为在甲的基础上,压强增大一倍,平衡向正反应移动,丙中参加反应的CO的物质的量大于甲中的2倍;
(3)根据已知条件求出甲醇在5min和8min时的物质的量浓度,然后再作图即可.
解答 解:(1)CO的起始浓度=$\frac{1mol}{2L}$=0.5mol/L,氢气的起始浓度=$\frac{2mol}{2L}$=1mol/L,达到平衡时c(CH3OH)=$\frac{0.5mol}{2L}$=0.25mol/L,则:
CO(g)+2H2(g)?CH3OH(g)
起始(mol/L):0.5 1 0
变化(mol/L):0.25 0.5 0.25
平衡(mol/L):0.25 0.5 0.25
所以:平衡常数K=$\frac{0.25}{0.25×0.{5}^{2}}$=4,
故答案为:4;
(2)A.甲、乙为等效平衡,平衡时CO的物质的量相等,令平衡时CO为amol,甲中CO转化率α1=$\frac{1-α}{1}$=1-a,平衡时甲醇的物质的量=(1-a)mol,乙中参加反应的甲醇为amol,乙中的转化率α2=a,故α1+α2=1,故A正确;
B.甲、乙为等效平衡,平衡时CO的物质的量相等,令平衡时CO为bmol,则甲中参加反应的CO为(1-b)mol,放出的热量Q1=d(1-b),乙中参加反应的甲醇为bmol,吸收的热量Q2=bd,故Q1+Q2=d(1-b)+bd=d,故B正确;
C.丙与甲相比,可以等效为在甲的基础上,压强增大一倍,平衡向正反应方向移动,转化率增大,即α3>α1 ,故C错误;
D.甲、乙为等效平衡,平衡时对应各组分的物质的量相等,二者压强等效,丙与甲相比,可以等效为在甲的基础上,压强增大一倍,平衡向正反应移动,平衡时混合气体的物质的量小于甲中的2倍,故压强P3<2P1=2P2 ,故D错误;
E.由D中分析可知,n2=0.5,n3>1.0mol,故E错误;
F.丙与甲相比,可以等效为在甲的基础上,压强增大一倍,平衡向正反应移动,丙中参加反应的CO的物质的量大于甲中的2倍,则Q3>2Q1,故F错误,
故答案为:AB;
(3)将甲容器的体系体积压缩到1L,若在第8min 达到新的平衡时,
2H2(g)+CO(g)?CH3OH(g)
初始量(mol):2 1 0
变化量(mol):1.31 0.652 0.652
平衡量(mol):0.69 0.348 0.652
所以达到平衡时,甲醇的物质的量浓度是0.652mol/L,在第5min时,由于体积减半,所以甲醇的浓度应该加倍,即为0.25mol/L×2=0.5mol/L,所以5-8min内,甲醇的物质的量浓度从0.5mol/L升高到0.652mol/L,如图所示: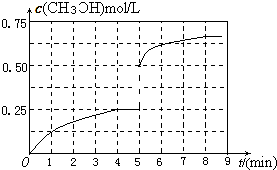 ;
;
故答案为: .
.
点评 本题考查较为综合,涉及化学平衡的计算、平衡图象绘制等,题目难度中等,要准确理解等效平衡问题,注意对结论的理解掌握.

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案| A. | 小于100 mL | B. | 等于100 mL | C. | 大于100 mL | D. | 等于100/ρ mL |
| A. | CH2═CH2+Br2→CH3CHBr2 | |
| B. | CH3CH═CH2+Br2→CH3CHBrCH2Br | |
| C. | CH3CH═CH2+Br2→CH3CH2CHBr2 | |
| D. | CH2═CH-CH═CH2+Br2(足量)→CH2═CH-CHBr-CH2Br |
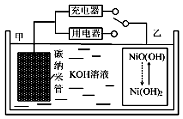 2016年8月,联合国开发计划署在中国的首个“氢经济示范城市”在江苏如皋落户.用吸附了H2的碳纳米管等材料制作的二次电池的原理如图所示.下列说法正确的是( )
2016年8月,联合国开发计划署在中国的首个“氢经济示范城市”在江苏如皋落户.用吸附了H2的碳纳米管等材料制作的二次电池的原理如图所示.下列说法正确的是( )| A. | 放电时,甲电极反应为:NiO(OH)+H2O+e?═Ni(OH)2+OH? | |
| B. | 放电时,甲电极为正极,OH?移向乙电极 | |
| C. | 电池总反应为H2+2NiO(OH)$?_{放电}^{充电}$ 2Ni(OH)2 | |
| D. | 充电时,电池的碳电极与直流电源的正极相连 |
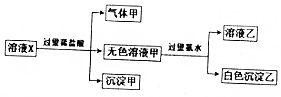 水溶液中只可能有K+、Mg2+、AlO2-、Al3+、SiO32-、CO32-、SO42-中的若干种离子,某同学对溶液进行了如下实验:下列判断错误的是( )
水溶液中只可能有K+、Mg2+、AlO2-、Al3+、SiO32-、CO32-、SO42-中的若干种离子,某同学对溶液进行了如下实验:下列判断错误的是( )| A. | 溶液X可能含有Mg2+或Al3+ | |
| B. | 沉淀甲只可能是硅酸沉淀 | |
| C. | 有气体甲生成,表明溶液X中一定含有CO32- | |
| D. | 不能确定SO42-是否存在于溶液X中 |
| A. | 用过滤的方法除去食盐水中的泥沙 | |
| B. | 用分液的方法分离乙醇和水的混合物 | |
| C. | 用萃取的方法提取碘水中的碘 | |
| D. | 用结晶的方法分离氯化钠和硝酸钾的混合物 |