题目内容
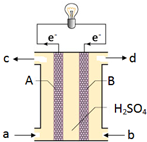 “长征”火箭发射使用的燃料是偏二甲肼(C2H8N2),并使用四氧化二氮作为氧化剂,这种组合的两大优点是,既能在短时间内产生巨大能量将火箭送上太空,产物又不污染空气(产物都是空气成分).某校外研究性学习小组拟将此原理设计为原电池,如图所示,结合学习过的电化学原理分析其设计方案,下列说法正确的是( )
“长征”火箭发射使用的燃料是偏二甲肼(C2H8N2),并使用四氧化二氮作为氧化剂,这种组合的两大优点是,既能在短时间内产生巨大能量将火箭送上太空,产物又不污染空气(产物都是空气成分).某校外研究性学习小组拟将此原理设计为原电池,如图所示,结合学习过的电化学原理分析其设计方案,下列说法正确的是( )| A、B为正极 |
| B、从a口通入四氧化二氮气体 |
| C、从d口排除的是NO气体 |
| D、A极发生的电极反应式:C2H8N2-16e-+8H2O=CO2+N2+16H+ |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:由电子转移方向可知A为负极,偏二甲肼被氧化石花菜氮气和二氧化碳,电极方程式为C2H8N2-16e-+4H2O=2CO2+N2+16H+,B为正极,发生还原反应,四氧化二氮被还原生成氮气,电极方程式为N2O4+8e-+8H+=N2+4H2O,结合电极方程式解答该题.
解答:
解:A.由电子转移方向可知A为负极,B为正极,故A正确;
B.A为负极,则从a口通入偏二甲肼,故B错误;
C.由题给信息“产物又不污染空气(产物都是空气成分)”,可知从d口排除的是氮气,故C错误;
D.偏二甲肼被氧化石花菜氮气和二氧化碳,电极方程式为C2H8N2-16e-+4H2O=2CO2+N2+16H+,故D错误.
故选A.
B.A为负极,则从a口通入偏二甲肼,故B错误;
C.由题给信息“产物又不污染空气(产物都是空气成分)”,可知从d口排除的是氮气,故C错误;
D.偏二甲肼被氧化石花菜氮气和二氧化碳,电极方程式为C2H8N2-16e-+4H2O=2CO2+N2+16H+,故D错误.
故选A.
点评:本题考查化学电源新型电池,为高频考点,侧重于学生的分析能力的考查,本题难度不大,注意电极反应式的书写,以此判断各电极的变化.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
根据如图的转化关系判断下列说法正确的是(反应条件已略去)( )
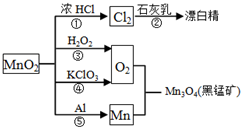

| A、反应①②③④⑤均属于氧化反应和离子反应 |
| B、反应⑤说明该条件下铝的还原性强于锰 |
| C、相同条件下生成等量的O2,反应③和④转移的电子数之比为1:1 |
| D、反应①中氧化剂与还原剂的物质的量之比为1:4 |
下列解释事实的方程式不准确的是( )
A、铝热法炼铁:Fe2O3+2Al
| ||||
B、工业上用NH3制备NO:4NH3+5O2
| ||||
| C、向受酸雨影响的湖泊中喷洒CaCO3粉末:CO32-+2H+═H2O+CO2↑ | ||||
| D、过氧化钠用于呼吸面具中作为氧气的来源:2Na2O2+2CO2═2Na2CO3+O2 |
下列说法正确的是( )
| A、SO2通入品红溶液,溶液褪色的原理与SO2通入溴水后褪色的原理相同 |
| B、浓硫酸具有强氧化性,稀硫酸不具有氧化性 |
| C、用浓FeCl3溶液和NaOH溶液混合制备Fe(OH)3胶体 |
| D、明矾和漂白粉常用于自来水的净化和杀菌消毒,但二者的作用原理不同 |
贝诺酯是解热镇痛抗炎药,其结构如图所示.下列有关说法正确的是( )
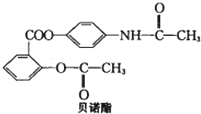

| A、分子式为C17H14O5N |
| B、在氢氧化钠水溶液中水解可以得到3种有机物钠盐 |
| C、1mol贝诺酯与H2发生加成反应最多消耗8mol H2 |
| D、贝诺酯既属于酯类又属于蛋白质类 |
下列说法正确的是( )
| A、常温下,反应4Fe(OH)2(s)+2H2O(l)+O2(g)═4Fe(OH)3(s)能自发进行,则△H<0 | ||
| B、铁片镀锌时,铁片与外电源的正极相连 | ||
| C、NaClO溶液中通入少量CO2,ClO-水解程度增大,溶液碱性增强 | ||
D、t℃时,恒容密闭容器中反应:NO2(g)+SO2(g)?NO(g)+SO3(g),通入少量O2,
|