题目内容
15. 氟的单质及其化合物在生产杀虫剂、灭火剂及特种塑料等方面用途广泛.
氟的单质及其化合物在生产杀虫剂、灭火剂及特种塑料等方面用途广泛.(1)在2%的氢氧化钠溶液中通入氯气,发生反应:2F2+2NaOH═2NaF+H2O+OF2.该反应氧化剂匀还原剂的物质的量之比为2:1,OF2的电子式为
 .
.(2)SF6是一种优良的绝缘气体,分子结构中只存在S-F键,己知1molS (s)转化为气态硫原子吸收能晕280KJ,F-F键能为160KJ•mol-1,S-F键能为330kJ•mol-1,试写出固态S单质和氟气反应生成SF6气体的热化学方程式S(s)+3F2(g)=SF6 △H=-1220kJ/mol.
(3)用含氟牙膏刷牙,氟离子会与牙釉质[主要成分为Ca5(PO4)3OH]发生反应:
Ca5(PO4)3OH(s)+F-(aq)?Ca5(PO4)3F(s)+OH-(aq),该反应的平衡常数K=2.5×1024(已知Ksp[Ca5(PO4)3OH]=7×l0-37,Ksp[Ca5(PO4)3F]=2.8×l0-61).
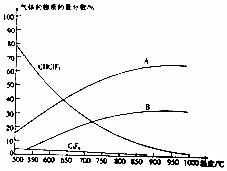
(4)聚四氟化烯常用于炊具的“不粘涂层”.制备四氟化烯的反应原理为2CHClF2(g)?C2F4(g)+2HCl(g) (反应1),副反应为3CHClF2(g)?C3H6(g)+3HCl(g) (反应11),反应达到平衡时各气体的物质的量分数随温度的变化如图所示.
①在恒温,恒容的条件下,下列能够说明反应I达到化学平衡状态的是BD
A.混合气体密度不再改变
B.混合气体平均相对分子质量不再改变
C.V正(C2F4)=2V逆(HCl)
D.c(CHClF2)与c(HCl)比值保持不变
②图中曲线A表示的物质是HCl(填化学式).
③反应2CHClF2(g)?C2F4(g)+2HCl(g) 的△H>0(填“>”或“<”)
④工业上常在900℃以上通过裂解CHClF2来制取C2F4,其原因是C2F4的产率高,副产物C3F6的含量几乎为0.
(5)25℃时,向amol/L的NaF溶液中滴加等体积bmol/L的盐酸使溶液呈中性(不考虑盐酸与氢氟酸的挥发,忽略溶液体积变化),则HF的电离平衡常数Ka=$\frac{1{0}^{-7}(a-b)}{b}$.(用含a和b的代数式表示)
分析 (1)元素的化合价降低的反应物为氧化剂,元素的化合价升高的反应物为还原剂,据此分析解答,OF2中氟原子最外层达到8电子稳定结构,漏掉了F周围的6个电子;
(2)根据反应热△H=反应物总键能-生成物总键能计算反应热;
(3)Ca5(PO4)3F溶度积比Ca5(PO4)3OH小,从难溶电解质的溶解平衡的角度分析,结合K的计算表达式及Ksp计算;
(4)①反应达到平衡状态的标志是正逆反应速率相同,各组分含量保持不变分析选项;
②A物质的量一直在增加,且增加量最大,为氯化氢;
③温度升高平衡向吸热的方向移动;
④通过图示可知,在900℃以上,副产物C3F6的含量几乎为0;
(5)盐酸和NaF之间反应生成氯化钠和HF,溶液显示中性,所以NaF会剩余,c(H+)=c(OH-)=10-7mol/L,由于溶液体积加倍,则离子浓度均减半,故c(Cl-)=0.5bmol/L,而根据溶液的电中性可知:c(F-)+c(Cl-)=c(Na+)=0.5amol/L,所以c(F-)=(0.5a-0.5b)mol/L,根据HF的电离常数表达式来计算.
解答 解:(1)2F2+2NaOH═2NaF+H2O+OF2,该反应中F的化合价变化为(0→-1)、O元素的化合价变化为(0→+2)氧化剂为F2,还原剂为NaOH,氧化剂与还原剂的物质的量之比为2:1,二氟化氧分子中F原子最外层达到8电子稳定结构,其正确的电子式为 ,
,
故答案为:2:1;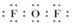 ;
;
(2)反应热△H=反应物总键能-生成物总键能,所以对于S(s)+3F2(g)═SF6(g),其反应热△H=280kJ/mol+3×160kJ/mol-6×330kJ/mol=-1220kJ/mol,即S(s)+3F2(g)=SF6 △H=-1220kJ/mol,
故答案为:S(s)+3F2(g)=SF6 △H=-1220kJ/mol;
(3)Ca5(PO4)3F溶度积比Ca5(PO4)3OH小,羟基磷酸钙在水中存在平衡:Ca5(PO4)3OH(s)?5Ca2+(aq)+3PO43-(aq)+OH-(aq),含氟牙膏中的F-与该平衡中的Ca2+、PO43-结合成更难溶的Ca5(PO4)3F,使平衡向右移动,牙齿表面的羟基磷酸钙转化成了氟磷酸钙,使牙齿得到保护,发生的离子反应为Ca5(PO4)3OH+F-=Ca5(PO4)3F+OH-,该反应的平衡常数K=$\frac{C(O{H}^{-})}{C({F}^{-})}$=$\frac{7×1{0}^{-37}}{2.8×1{0}^{-61}}$=2.5×1024;
故答案为:2.5×1024;
(4)①A.制备四氟化烯反应前后都为气体,在恒容的条件下,混合气体密度始终保持改变,故A错误;
B.制备四氟化烯的反应,反应前后物质的量在变化,混合气体的平均相对分子质量M=$\frac{m}{n}$,气体的质量在反应前后是守恒的,是一个反应前后物质的量会变化的反应,所以当M不变时,达到了平衡,故B正确;
C.2CHClF2(g)?C2F4(g)+2HCl(g) (反应1),副反应为3CHClF2(g)?C3H6(g)+3HCl(g) (反应11),需满足V正(C2F4)=5V逆(HCl),故C错误;
D.c(CHClF2)与c(HCl)比值保持不变,说明各物质的量不变,达到了平衡,故D正确;
故答案为:BD;
②由2CHClF2(g)?C2F4(g)+2HCl(g) (反应1),副反应为3CHClF2(g)?C3H6(g)+3HCl(g) (反应11)可知氯化氢的物质的量一直在增加,且增加量最大,所以A为氯化氢,
故答案为:HCl;
③根据图示可知,随着温度的升高CHClF2物质的量在减少,所以正反应为吸热反应,即2CHClF2(g)?C2F4(g)+2HCl(g) 的△H>0,
故答案为:>;
④通过图示可知,在900℃以上,副产物C3F6的含量几乎为0,工业上常在900℃以上通过裂解CHClF2来制取C2F4,其原因是C2F4的产率高,副产物C3F6的含量几乎为0,
故答案为:C2F4的产率高,副产物C3F6的含量几乎为0;
(5)盐酸和NaF之间反应生成氯化钠和HF,溶液显示中性,所以NaF会剩余,则生成的c(HF)=0.5bmol/L,溶液显中性,故c(H+)=c(OH-)=10-7mol/L,根据电荷守恒,c(Cl-)=0.5bmol/L,c(F-)+c(Cl-)=c(Na+)=0.5amol/L,所以c(F-)=(0.5a-0.5b)mol/L,HF的电离常数Ka=$\frac{C({H}^{+})•C({F}^{-})}{C(HF)}$=$\frac{1{0}^{-7}×(0.5a-0.5b)}{0.5a}$=$\frac{1{0}^{-7}(a-b)}{b}$,
故答案为:$\frac{1{0}^{-7}(a-b)}{b}$.
点评 本题考查了氟的单质及其化合物,涉及电子式、反应热的计算、化学平衡、混合溶液中的弱电解质的电离平衡常数的计算等,题目难度中等,(5)注意计算过程中的电荷守恒和物料守恒的运用.

| A. | CuO+H2═Cu+H2O | B. | CuO+CO═CO2+Cu | ||
| C. | Fe+CuSO4═Cu+FeSO4 | D. | Cu2(OH)2CO3═2CuO+H2O+CO2↑ |
| A. | 由电离常数分析,CH3COOH溶液的pH一定比HCIO溶液的pH小 | |
| B. | 物质的量浓度相等的CH3COONa和NaClO混合溶液中,各离子浓度大小关系为:c(Na+)>c(CIO-)>c(CH3COO-)>c(OH)>c(H+) | |
| C. | 25℃时,反应 AgCl(s)+Br-(aq)?AgBr(s)+Cl-(aq)的平衡常数K=800 | |
| D. | 物质的置浓度相等的NaClO溶液和CH3COONa溶液相比较,两者离子的总浓度相等 |
| 选项 | 目的 | 试验方法 |
| A | 除去Na2CO3固体中的NaHCO3 | 置于蒸发皿中加热至恒重 |
| B | 除去NaCl中少量KNO3 | 将混合物制成热饱和溶液,冷却结晶,过滤 |
| C | 除去CO2中的HCl | 通过NaHCO3(aq,饱和),然后干燥 |
| D | 除去C2H5Br中的Br2 | 加入足量Na2SO3(aq),充分振荡,蒸馏 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 12 g金刚石含有的共价铤数目为2NA | |
| B. | 标准状况下,2.24L乙醇中碳氢键的数目为0.5Na | |
| C. | 1 mol NH3中含有3NA对共用电子对 | |
| D. | 常温常压下,8gO2含有4NA个质子 |
| A. | c(Fe3+)=0.1mol•L-1的溶液中:K+、ClO-、SO42-、NO3- | |
| B. | 在某无色溶液中:MnO4-、K+、H+、IO3- | |
| C. | 在$\frac{c({H}^{+})}{c(O{H}^{-})}$=10-12的溶液中:K+、Na+、ClO-、NO3- | |
| D. | 水电离出 c(H+)=10-12 的溶液中:Mg2+、Cu2+、SO42-、K+ |
| 温度/℃ | 85 | 95 | 100 | 110~240 | 280 | 300 | 340 | |
| 质量分数(%) | 苯 | 96.05 | 91.55 | 80.85 | 0 | 23.35 | 36.90 | 72.37 |
| 环己烷 | 3.95 | 8.45 | 19.15 | 100 | 76.65 | 63.10 | 27.63 |
| A. | 当温度超过 280℃,苯的转化率迅速下降,可能是因为该反应为吸热的可逆反应 | |
| B. | 在 110~240℃苯的转化率为 100%.说明该镍催化剂活性较高,能够在较宽的温度范围内催化而且不发生副反应 | |
| C. | 增大压强与提高氢气、苯的物质的量比都有利于提高苯的转化率 | |
| D. | 由表中数据来看,随着反应温度的升高,苯的转化率先升高后降低 |
| A. | 升高温度,K减小 | B. | 减小压强,n(CO2)增加 | ||
| C. | 更换高效催化剂,α(CO)增大 | D. | 充入一定量的氮气,n(H2)不变 |
| A. | 146:87 | B. | 73:87 | C. | 87:146 | D. | 87:73 |