题目内容
6.25℃时,Ka(CH3COOH)=1.8×10-5、Ka(HClO)=3.0×10-8、Ksp=4.0×10-10、Ksp(AgBr)=5.0×10-13.下列说法正确的是( )| A. | 由电离常数分析,CH3COOH溶液的pH一定比HCIO溶液的pH小 | |
| B. | 物质的量浓度相等的CH3COONa和NaClO混合溶液中,各离子浓度大小关系为:c(Na+)>c(CIO-)>c(CH3COO-)>c(OH)>c(H+) | |
| C. | 25℃时,反应 AgCl(s)+Br-(aq)?AgBr(s)+Cl-(aq)的平衡常数K=800 | |
| D. | 物质的置浓度相等的NaClO溶液和CH3COONa溶液相比较,两者离子的总浓度相等 |
分析 A、溶液的PH与溶液中氢离子的浓度有关,电离度大溶液中氢离子的浓度不一定大;
B、由电离度可知:Ka(CH3COOH)=1.8×10-5、Ka(HClO)=3.0×10-8,次氯酸的酸性弱于醋酸,根据越弱越水解;
C、AgCl(s)+Br-(aq)?AgBr(s)+Cl-(aq)的平衡常数K=$\frac{c(C{l}^{-})}{c(B{r}^{-})}$=$\frac{c(A{g}^{+})•c(C{l}^{-})}{c(A{g}^{+})•c(B{r}^{-})}$=$\frac{{K}_{sp}(AgCl)}{{K}_{sp}(AgBr)}$;
D、设浓度均为:0.1mol/L,NaClO溶液中的c(Na+)=0.1mol/L,则溶液中的电荷守恒有:c(Na+)+c(H+)=c(ClO-)+c(OH-);
CH3COONa溶液中的c(Na+)=0.1mol/L,溶液中的电荷守恒有:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),两溶液中的c(Na+)相同,但水解程度不同,次氯酸钠的水解程度大,所以醋酸钠中氢离子的浓度大于次氯酸钠,则有:c(ClO-)+c(OH-)<c(CH3COO-)+c(OH-),所以离子总数:NaClO溶液<CH3COONa溶液.
解答 解:A、溶液的PH与溶液中氢离子的浓度有关,电离度大溶液中氢离子的浓度不一定大,还酸本身浓度大小有关,而酸的浓度不知,故A错误;
B、由电离度可知:Ka(CH3COOH)=1.8×10-5、Ka(HClO)=3.0×10-8,次氯酸的酸性弱于醋酸,根据越弱越水解,所以同浓度次氯酸根离子的水解程度大于醋酸根离子的水解程度,所以溶液中次氯酸根离子的浓度小于醋酸根离子的浓度,则各离子的浓度大小关系为:c(Na+)>c(CH3COO-)>c(CIO-)>c(OH)>c(H+),故B错误;
C、AgCl(s)+Br-(aq)?AgBr(s)+Cl-(aq)的平衡常数K=$\frac{c(C{l}^{-})}{c(B{r}^{-})}$=$\frac{c(A{g}^{+})•c(C{l}^{-})}{c(A{g}^{+})•c(B{r}^{-})}$=$\frac{{K}_{sp}(AgCl)}{{K}_{sp}(AgBr)}$=$\frac{4.0×1{0}^{-10}}{5.0×1{0}^{-13}}$=800,故C正确;
D、设浓度均为:0.1mol/L,NaClO溶液中的c(Na+)=0.1mol/L,则溶液中的电荷守恒有:c(Na+)+c(H+)=c(ClO-)+c(OH-);CH3COONa溶液中的c(Na+)=0.1mol/L,溶液中的电荷守恒有:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),两溶液中的c(Na+)相同,但水解程度不同,次氯酸钠的水解程度大,所以醋酸钠中氢离子的浓度大于次氯酸钠,则有:c(ClO-)+c(OH-)<c(CH3COO-)+c(OH-),所以离子总数:NaClO溶液<CH3COONa溶液,而不是相等,故D错误;
故选C.
点评 本题考查了电离度、盐的水解、化学平衡常数表达式,两盐溶液中的离子个数的大小比较,应从盐的种类来分析其能否水解,并从电荷守恒的角度入手,难度不大.

 阅读快车系列答案
阅读快车系列答案| A. | 用石墨作电极电解饱和食盐水时,若阴极得到2 NA个电子,则阳极产生22.4 L气体 | |
| B. | 2 L 0.05 mol•L-1乙酸溶液中H+数目为0.1 NA | |
| C. | 足量的Cu与含有0.2 mol H2SO4的浓硫酸共热可生成SO2为0.1 NA | |
| D. | 7.8 g Na2S 和Na2O2的混合物中,含有的阴离子数目为0.1 NA |
| 化合物 | 燃烧热 | 化合物 | 燃烧热 |
| 甲烷 | 891.0 | 正丁烷 | 2878.0 |
| 乙烷 | 1560.8 | 异丁烷 | 2869.6 |
| 丙烷 | 2221.5 | 2-甲基丁烷 | 3531.3 |
| A. | 乙烷燃烧的热化学方程式为:2C2H6(g)+7O2(g)=4CO2(g)+6H2O(g)△H=-1560.8 kJ/mol | |
| B. | 稳定性:正丁烷>异丁烷 | |
| C. | 正戊烷的燃烧热大于3531.3kJ/mol | |
| D. | 相同质量的烷烃,碳的质量分数越大,燃烧放出的热量越多 |
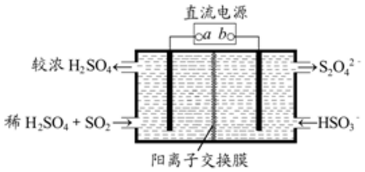 利用如图所示装置(电极均为惰性电极)可吸收SO2,并用阴极排出的溶液可吸收NO2.下列说法正确的是( )
利用如图所示装置(电极均为惰性电极)可吸收SO2,并用阴极排出的溶液可吸收NO2.下列说法正确的是( )| A. | a为直流电源的负极 | |
| B. | 与 b电极相连的电极反应式为:2HSO3-+2H++2e-═S2O42-+2H2O | |
| C. | 与 a相连的电极发生还原反应得到SO42- | |
| D. | 电解时,H+由阴极室通过阳离子交换膜到阳极室 |
| A. | C2H4、C2H5OH、HOCH2CH2COOH | B. | CH2O、C2H4O2、C6H12O6 | ||
| C. | C6H6、C5H10、C8H6O2 | D. | H2、CO、CH3OH |
 乙酸橙花酯兼有橙花和玫瑰花香气,其结构简式如图.关于该有机物的叙述中正确的是
乙酸橙花酯兼有橙花和玫瑰花香气,其结构简式如图.关于该有机物的叙述中正确的是①在Ni催化条件下1mol该有机物可与3mol H2发生加成;
②该有机物不能发生银镜反应;
③该有机物分子式为C12H22O2;
④该有机物的同分异构体中不可能有酚类;
⑤1mol该有机物水解时只能消耗1mol NaOH( )
| A. | ②④⑤ | B. | ①④⑤ | C. | ②③⑤ | D. | ①②③ |
| A. | SiO2、MgO熔点高,可用于制作耐高温仪器 | |
| B. | 天然气是可再生清洁能源,可用于工业制盐酸 | |
| C. | 硝酸铵属于氧化剂,严禁用可燃物(如纸袋)包装 | |
| D. | 纤维素属于多糖类物质,但不能作人类的营养物质 |
 氟的单质及其化合物在生产杀虫剂、灭火剂及特种塑料等方面用途广泛.
氟的单质及其化合物在生产杀虫剂、灭火剂及特种塑料等方面用途广泛. .
.