题目内容
15.实验室常用浓盐酸与二氧化锰反应MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O制取氯气,该反应中还原剂与氧化剂的质量比是( )| A. | 146:87 | B. | 73:87 | C. | 87:146 | D. | 87:73 |
分析 反应MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O中,Mn元素化合价由+4价降低到+2价,被还原,MnO2为氧化剂,4HCl参与反应,2HCl中Cl元素化合价由-1价升高到0价,被氧化,为还原剂,2HCl中Cl元素化合价不变作酸性,结合反应的方程式计算.
解答 解:反应MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O中,Mn元素化合价由+4价降低到+2价,被还原,MnO2为氧化剂,4HCl参与反应,2HCl中Cl元素化合价由-1价升高到0价,被氧化,为还原剂,2HCl中Cl元素化合价不变作酸性,所以还原剂和氧化剂的物质的量之比是2:1,则质量比是2×36.5:1×87=73:87,故选B.
点评 本题考查氧化还原反应的基本概念及根据方程式的有关计算等,侧重于学生的分析能力和计算能力的考查,比较基础,注意反应中HCl起酸性、还原剂作用,各占一半.

练习册系列答案
 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案
相关题目
20.用NA代表阿伏加德罗常数值,下列说法正确的是( )
| A. | 10.0g D2O和H218O的混合物所含质子总数为5 NA | |
| B. | 标准状况下,22.4 L己烷含有的共价键数目为19 NA | |
| C. | 1.01、0.1 mol.L-1 NaAlO2溶液中含有的氧原子数目为0.2NA | |
| D. | 1mol Na2O和BaO2的混合物中含有的阴、阳离子总数为3NA |
7. 如图两个装置中,溶液体积均为200mL,开始时,电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得导线上都通过了0.02mol e-,若不考虑溶液体积的变化,则下列叙述正确的是( )
如图两个装置中,溶液体积均为200mL,开始时,电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得导线上都通过了0.02mol e-,若不考虑溶液体积的变化,则下列叙述正确的是( )
 如图两个装置中,溶液体积均为200mL,开始时,电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得导线上都通过了0.02mol e-,若不考虑溶液体积的变化,则下列叙述正确的是( )
如图两个装置中,溶液体积均为200mL,开始时,电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得导线上都通过了0.02mol e-,若不考虑溶液体积的变化,则下列叙述正确的是( )| A. | 在①中Cu棒为阳极;在②中Cu棒为负极 | |
| B. | 溶液的pH:①不变;②增大 | |
| C. | 电极上析出物质的质量:①<② | |
| D. | 电极反应式:①中阳极:4OH--4e-=2H2O+O2↑;②中正极:2H++2e-=H2↑ |
4.化学与资源、环境、生活关系密切相关,下列说法正确的是( )
| A. | 煤燃烧时加入少量生石灰的目的是减少废气中的二氧化碳排放 | |
| B. | 空气中PM2.5(2.5微米以下的颗粒物)的存在可能形成丁达尔效应 | |
| C. | 葡萄糖、蔗糖、油脂和蛋白质等营养物质在人体吸收后都能被水解 | |
| D. | 在食品袋中放入盛有硅胶的透气小袋,可防止食物受潮、氧化变质 |
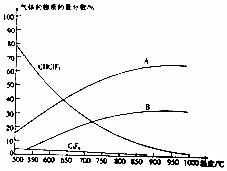 氟的单质及其化合物在生产杀虫剂、灭火剂及特种塑料等方面用途广泛.
氟的单质及其化合物在生产杀虫剂、灭火剂及特种塑料等方面用途广泛. .
. 反应aA(s)+bB(g)?cC(g)+dD(g)达到平衡时,B%跟压强P和温度T(T2>T1)之间的关系如图所示(填“增大”“减小”“吸”“放”“正”“逆”)
反应aA(s)+bB(g)?cC(g)+dD(g)达到平衡时,B%跟压强P和温度T(T2>T1)之间的关系如图所示(填“增大”“减小”“吸”“放”“正”“逆”)
 +
+ 则C9H8O的结构简式为
则C9H8O的结构简式为
 .
.