题目内容
某炼铁废渣中含有大量CuS及少量铁的化合物,工业上以该废渣为原料生产CuCl2?2H2O的工艺流程如下: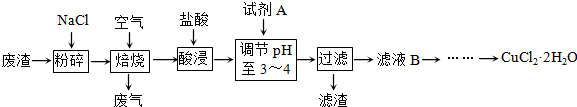
回答下列问题:
(1)焙烧过程中发生的主要反应为: CuS+ NaCl+ O2
CuCl2+ Na2SO4.配平上述化学方程式.
(2)试剂A应选用 .(填编号)
①NaClO ②Cl2 ③H2O2溶液 ④浓硫酸
理由是 .
(3)滤液B中大量含有的离子有 .
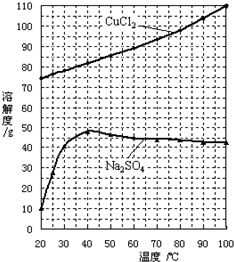
(4)为了获得CuCl2?2H2O晶体,对滤液B进行的操作是:蒸发浓缩,趁热过滤,滤液经冷却结晶,过滤得到产品.分析有关物质的溶解度曲线(如图),“趁热过滤”得到的固体是 ,“冷却结晶”过程中,析出CuCl2?2H2O晶体的合适温度为 .

回答下列问题:
(1)焙烧过程中发生的主要反应为:
| ||
(2)试剂A应选用
①NaClO ②Cl2 ③H2O2溶液 ④浓硫酸
理由是
(3)滤液B中大量含有的离子有
(4)为了获得CuCl2?2H2O晶体,对滤液B进行的操作是:蒸发浓缩,趁热过滤,滤液经冷却结晶,过滤得到产品.分析有关物质的溶解度曲线(如图),“趁热过滤”得到的固体是

考点:物质分离和提纯的方法和基本操作综合应用,氧化还原反应方程式的配平
专题:实验设计题
分析:(1)利用化合价升降相等配出氧化剂和还原剂的化学计量数,然后根据原子守恒把其他物质配平;
(2)试剂A满足能把亚铁离子氧化为铁离子和调节PH使酸性减弱两个功能;
(3)经过盐酸酸浸,NaClO调节PH值,过滤掉氢氧化铁后,溶液中还有Cu2+、Na+、Cl-、SO42-;
(4)蒸发浓缩后,由于同温下硫酸钠的溶解度小,会有大量硫酸钠析出;
40摄氏度时硫酸钠溶解度最大,硫酸钠最不容易析出,为了得到更多的析出CuCl2?2H2O晶体,温度略低于40℃的范围.
(2)试剂A满足能把亚铁离子氧化为铁离子和调节PH使酸性减弱两个功能;
(3)经过盐酸酸浸,NaClO调节PH值,过滤掉氢氧化铁后,溶液中还有Cu2+、Na+、Cl-、SO42-;
(4)蒸发浓缩后,由于同温下硫酸钠的溶解度小,会有大量硫酸钠析出;
40摄氏度时硫酸钠溶解度最大,硫酸钠最不容易析出,为了得到更多的析出CuCl2?2H2O晶体,温度略低于40℃的范围.
解答:
解:(1)CuS→Na2SO4 S化合价升高8,O2→Na2SO4 O化合价降低2,O2化合价降低2×2=4,根据化合价升降相等可得,CuS化学计量数为1,氧气的化学计量数为2,根据元素守恒Na2SO4化学计量数为1,NaCl化学计量数为2,CuCl2化学计量数为1,配平化学方程式为CuS+2NaCl+2O2
CuCl2+Na2SO4;
故答案为:1;2;2;1;1;
(2)NaClO、Cl2、H2O2溶液、浓硫酸均能将Fe2+氧化为Fe3+,但氯水和硫酸溶液均呈酸性,NaClO溶液呈碱性,H2O2溶液与Fe2+反应消耗H+,故可以起到调节PH的作用,
故答案为:①③;NaClO能将Fe2+氧化为Fe3+,且溶液显碱性,能增大溶液pH使Fe3+沉淀;
(3)经过盐酸酸浸,NaClO调节PH值,过滤掉氢氧化铁后,溶液中还有Cu2+、Na+、Cl-、SO42-;故答案为:Cu2+、Na+、Cl-、SO42-;
(4)由图乙可知硫酸钠的溶解度较小而且温度较高时随温度的变化不大,为了防止氯化铜晶体的析出,必须趁热过滤,加热浓缩时会有大量的硫酸钠析出;
冷却结晶时尽量保证硫酸钠不析出,而40摄氏度时硫酸钠溶解度最大,为了能析出更多的CuCl2?2H2O晶体,故适宜温度为35~40℃.
故答案为:Na2SO4;35~40℃.
| ||
故答案为:1;2;2;1;1;
(2)NaClO、Cl2、H2O2溶液、浓硫酸均能将Fe2+氧化为Fe3+,但氯水和硫酸溶液均呈酸性,NaClO溶液呈碱性,H2O2溶液与Fe2+反应消耗H+,故可以起到调节PH的作用,
故答案为:①③;NaClO能将Fe2+氧化为Fe3+,且溶液显碱性,能增大溶液pH使Fe3+沉淀;
(3)经过盐酸酸浸,NaClO调节PH值,过滤掉氢氧化铁后,溶液中还有Cu2+、Na+、Cl-、SO42-;故答案为:Cu2+、Na+、Cl-、SO42-;
(4)由图乙可知硫酸钠的溶解度较小而且温度较高时随温度的变化不大,为了防止氯化铜晶体的析出,必须趁热过滤,加热浓缩时会有大量的硫酸钠析出;
冷却结晶时尽量保证硫酸钠不析出,而40摄氏度时硫酸钠溶解度最大,为了能析出更多的CuCl2?2H2O晶体,故适宜温度为35~40℃.
故答案为:Na2SO4;35~40℃.
点评:本题考查了物质的分离和提纯、离子的检验及沉淀溶解平衡,难度中等.注意除杂不能引入新的杂质,重结晶法提纯物质温度的选择是易出错点.

练习册系列答案
 一线名师权威作业本系列答案
一线名师权威作业本系列答案
相关题目
NA代表阿伏加德罗常数,下列说法中正确的是( )
| A、标况下,11.2 L氯气完全溶于1 L水中,所得溶液中Cl-和ClO-两种粒子数之和为NA |
| B、80mL 10mol?L-1 盐酸与足量MnO2加热反应,产生Cl2分子数为0.2NA |
| C、含有4 NA个碳碳σ键的金刚石,其质量为24 g |
| D、含0.1 mol FeCl3的溶液完全水解后得到的胶体粒子个数为0.1 NA |
某废水含有下列离子中的5种(忽略水的电离及离子的水解),K+、Cu2+、Al3+、Fe2+、Cl-、CO32-、NO3-、SO42-,测得各种离子的物质的量浓度相等.为探究废水的组成,某同学进行了如下实验:
①用铂丝蘸取少量溶液,在火焰上灼烧,透过蓝色钴玻璃观察无紫色火焰.
②另取溶液加入足量稀盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变.
③另取溶液加入BaCl2溶液,有白色沉淀生成.
根据上述实验,以下推测正确的是( )
①用铂丝蘸取少量溶液,在火焰上灼烧,透过蓝色钴玻璃观察无紫色火焰.
②另取溶液加入足量稀盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变.
③另取溶液加入BaCl2溶液,有白色沉淀生成.
根据上述实验,以下推测正确的是( )
| A、溶液中无法确定Al3+的存在与否 |
| B、原溶液中不含的离子为:K+、Al3+、CO32- |
| C、步骤②中可以确定Fe2+、NO3-的存在 |
| D、步骤③中共有2种钡盐沉淀 |
肼(N2H4)是火箭发动机的一种燃料,反应时N2O4为氧化剂,反应生成N2和水蒸气.
已知:N2(g)+2O2(g)=N2O4(g);△H=+8.7kJ/mol
N2H4(g)+O2(g)=N2(g)+2H2O(g);△H=-534kJ/mol
下列表示肼和N2O4反应的热化学方程式,正确的是( )
已知:N2(g)+2O2(g)=N2O4(g);△H=+8.7kJ/mol
N2H4(g)+O2(g)=N2(g)+2H2O(g);△H=-534kJ/mol
下列表示肼和N2O4反应的热化学方程式,正确的是( )
| A、2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g);△H=-1076.7 kJ/mol | ||||
B、N2H4(g)+
| ||||
| C、2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g);△H=-542.7 kJ/mol | ||||
| D、2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g);△H=-1059.3 kJ/mol |
两种气态烃组成的混合气体0.1mol,完全燃烧得0.16molCO2和3.6gH2O,下列说法正确的是( )
| A、混合气体中一定有甲烷 |
| B、混合气体一定是甲烷和乙烯 |
| C、混合气体中一定没有乙炔 |
| D、混合气体中一定有丙炔 |