题目内容
将一定量的氯气通入含59.5g KBr的溶液中,充分反应后,将溶液蒸干得固体41.7g.求:
(1)通入氯气的体积;
(2)原KBr溶液中,有多少克KBr参加了反应?
(1)通入氯气的体积;
(2)原KBr溶液中,有多少克KBr参加了反应?
考点:化学方程式的有关计算
专题:计算题
分析:发生反应2KBr+Cl2=Br2+2KCl,利用固体质量差,根据差量法计算参加反应的氯气、KBr的物质的量,根据V=nVm计算氯气的体积,根据m=nM计算参加反应KBr的质量.
解答:
解:反应后固体质量减小为59.5g-41.7g=17.8g
2 KBr+Cl2=Br2+2KCl 固体质量差△m
2mol 1mol 160g-71g=89g
n(KBr) n(Cl2) 17.8g
故n(KBr)=2mol×
=0.4mol,
n(Cl2)=1mol×
=0.2mol,
(1)通入氯气的体积为0.2mol×22.4L/mol=4.48L,
答:通入氯气的体积为4.48L.
(2)参加反应KBr的质量为0.4mol×119g/mol=47.6g,
答:原KBr溶液中有47.6gKBr参加了反应.
2 KBr+Cl2=Br2+2KCl 固体质量差△m
2mol 1mol 160g-71g=89g
n(KBr) n(Cl2) 17.8g
故n(KBr)=2mol×
| 17.8g |
| 89g |
n(Cl2)=1mol×
| 17.8g |
| 89g |
(1)通入氯气的体积为0.2mol×22.4L/mol=4.48L,
答:通入氯气的体积为4.48L.
(2)参加反应KBr的质量为0.4mol×119g/mol=47.6g,
答:原KBr溶液中有47.6gKBr参加了反应.
点评:本题考查根据方程式进行的计算,难度不大,注意利用差量法进行的计算.

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
下列化学用语的表达正确的是( )
A、氯原子的核外电子排布图: |
B、氮气分子的电子式: |
| C、乙炔分子的结构式:CH≡CH |
D、CH4分子的比例模型: |
一定量的盐酸跟过量的铁粉反应时,为了减缓反应速率,且不影响生成氢气的总量,可向盐酸中加入适量的( )
| A、NaOH(固体) |
| B、H2O |
| C、HCl |
| D、CH3COONa(固体) |
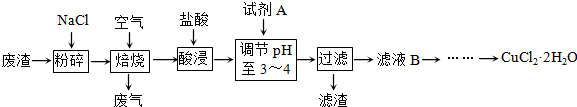
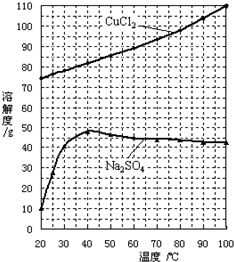
 现在七种元素,其中A、B、C、D、E为短周期元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答下列问题.
现在七种元素,其中A、B、C、D、E为短周期元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答下列问题. 该同学所画的电子排布图违背了
该同学所画的电子排布图违背了