题目内容
7.下列有关物质的性质与应用不相对应的是( )| A. | 铝的熔点很高,可用于制作耐高温材料 | |
| B. | Na2O2能与水和二氧化碳反应生成氧气,可用于呼吸面具中作为氧气的来源 | |
| C. | 明矾能在天然水中生成Al(OH)3胶体,可用作净水剂 | |
| D. | 用氢氟酸雕刻玻璃,是由于氢氟酸能与二氧化硅反应 |
分析 A.氧化铝的熔点高,Al的熔点不大;
B.Na2O2能与水和二氧化碳反应生成氧气,为提供氧气的反应原理;
C.明矾中铝离子水解生成胶体,具有吸附性;
D.玻璃中的二氧化硅能和氢氟酸发生反应;
解答 解:A.氧化铝的熔点高,Al的熔点不大,则氧化铝用于制作耐高温材料,故A错误;
B.Na2O2能与人呼出的二氧化碳反应生成氧气,为提供氧气的反应原理,则Na2O2可用于呼吸面具中作为氧气的来源,故B正确;
C.明矾中铝离子水解生成胶体,具有吸附性,则用作净水剂,故C正确;
D.玻璃中的二氧化硅能和氢氟酸发生反应,用氢氟酸雕刻玻璃,故D正确;
故选A.
点评 本题考查物质的性质,综合考查元素化合物知识,把握物质的性质、发生的反应、性质与用途的关系为解答的关键,注重基础知识的考查,题目难度不大.

练习册系列答案
 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案
相关题目
17.下列说法错误的是( )
| A. | 含有共价键的化合物一定是共价化合物 | |
| B. | 在共价化合物中一定含有共价键 | |
| C. | 含有离子键的化合物一定是离子化合物 | |
| D. | 非极性键也可存在于离子化合物中 |
18.有机物的结构简式如图所示,说法中正确的是( )


| A. | 该物质苯环上的三氯代物有 4 种 | |
| B. | 1 mol 该物质和 H2加成最多需要H2的物质的量为 2 mol | |
| C. | 能使溴水褪色,1 mol 该物质和溴水混合,最多消耗 Br2的物质的量为 5 mol | |
| D. | 该物质难溶于水,能使酸性高锰酸钾溶液褪色,且发生的是加成反应 |
15.根据等电子原理,由短周期元素组成的粒子,只要其电子总数相同,均可互称为等电子体.等电子体之间结构相似、物理性质也相近.以下各组粒子不能互称为等电子体的( )
| A. | CO和N2 | B. | N2H4 和C2H4 | C. | CO2和N2O | D. | O3和SO2 |
2.下列烷烃命名正确的是( )
| A. | 2-二甲基-3-乙基丁烷 | B. | 2,2,3-三甲基戊烷 | ||
| C. | 2,2-二甲基-3-乙基丁烷 | D. | 3,4,4-三甲基戊烷 |
12.关于热化学方程式:2H2(g)+O2(g)=2H2O(1),H=-571.6kJ•mol-1,下列叙述正确的是( )
| A. | 2mol气态H2与1mol气态氧气完全燃烧生成2mol液态水时放出571.6 kJ的热量 | |
| B. | 1mol气态H2与0.5mol气态氧气完全燃烧生成1mol液态水时吸收285.8kJ的热量 | |
| C. | 2个氢分子完全燃烧生成液态水时放出571.6 kJ的热量 | |
| D. | 上述热化学方程式可表示为H2(g)+O2(g)=H2O(1),H=-285.8 kJ•mol-1 |
19.下列有关化学与生活的叙述错误的是( )
| A. | 利用太阳能、潮汐能、风力发电,可以获取清洁能源 | |
| B. | 食用油和汽油都属于酯类,都能用来工业上制肥皂 | |
| C. | 利用可降解的“玉米塑料”生产一次性饭盒,可防止白色污染 | |
| D. | 地沟油若被回收重新流入餐桌,对人体伤害极大,应倡导加工处理生成生物柴油 |
16.下列有关化学用语正确的是( )
| A. | 离子结构示意图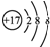 :可以表示35Cl-,也可以表示37Cl- :可以表示35Cl-,也可以表示37Cl- | |
| B. | 电子式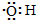 :可以表示羟基,也可以表示氢氧根离子 :可以表示羟基,也可以表示氢氧根离子 | |
| C. | 比例模型 :可以表示甲烷分子,也可以表示四氯化碳分子 :可以表示甲烷分子,也可以表示四氯化碳分子 | |
| D. | 聚丙烯的结构简式: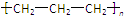 |
17.钒是一种重要的合金元素,还用于催化剂和新型电池.从含钒固体废弃物(含有SiO2、Al2O3及其他残渣)中提取钒的一种新工艺主要流程如图1:

部分含钒化合物在水中的溶解性如表:
请回答下列问题:
(1)反应①所得溶液中除H+之外的阳离子有VO2+和Al3+.
(2)反应②碱浸后滤出的固体主要成分是Al(OH)3(写化学式).
(3)反应④的离子方程式为VO3-+NH4+=NH4VO3↓.
(4)25℃、101 kPa时,4Al(s)+3O2(g)═2Al2O3(s)△H1=-a kJ/mol
4V(s)+5O2(g)═2V2O5(s)△H2=-b kJ/mol
用V2O5发生铝热反应冶炼金属钒的热化学方程式是10Al(s)+3V2O5(s)=5Al2O3(s)+6V(s)△H=-$\frac{5a-3b}{2}$kJ/mol.
(5)钒液流电池(如图2所示)具有广阔的应用领域和市场前景,该电池中隔膜只允许H+通过.电池放电时负极的电极反应式为V2+-e-=V3+,电池充电时阳极的电极反应式是VO2+-e-+H2O=VO2++2H+.
(6)用硫酸酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定反应①后溶液中的含钒量,反应的离子方程式为:2VO${\;}_{2}^{+}$+H2C2O4+2H+═2VO2++2CO2↑+2H2O.取25.00mL0.1000 mol/L
H2C2O4标准溶液于锥形瓶中,加入指示剂,将待测液盛放在滴定管中,滴定到终点时消耗待测液24.0mL,由此可知,该(VO2)2SO4溶液中钒的含量为10.6g/L.

部分含钒化合物在水中的溶解性如表:
| 物质 | V2O5 | NH4VO3 | VOSO4 | (VO2)2SO4 |
| 溶解性 | 难溶 | 难溶 | 可溶 | 易溶 |
(1)反应①所得溶液中除H+之外的阳离子有VO2+和Al3+.
(2)反应②碱浸后滤出的固体主要成分是Al(OH)3(写化学式).
(3)反应④的离子方程式为VO3-+NH4+=NH4VO3↓.
(4)25℃、101 kPa时,4Al(s)+3O2(g)═2Al2O3(s)△H1=-a kJ/mol
4V(s)+5O2(g)═2V2O5(s)△H2=-b kJ/mol
用V2O5发生铝热反应冶炼金属钒的热化学方程式是10Al(s)+3V2O5(s)=5Al2O3(s)+6V(s)△H=-$\frac{5a-3b}{2}$kJ/mol.
(5)钒液流电池(如图2所示)具有广阔的应用领域和市场前景,该电池中隔膜只允许H+通过.电池放电时负极的电极反应式为V2+-e-=V3+,电池充电时阳极的电极反应式是VO2+-e-+H2O=VO2++2H+.
(6)用硫酸酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定反应①后溶液中的含钒量,反应的离子方程式为:2VO${\;}_{2}^{+}$+H2C2O4+2H+═2VO2++2CO2↑+2H2O.取25.00mL0.1000 mol/L
H2C2O4标准溶液于锥形瓶中,加入指示剂,将待测液盛放在滴定管中,滴定到终点时消耗待测液24.0mL,由此可知,该(VO2)2SO4溶液中钒的含量为10.6g/L.