题目内容
17.下列说法错误的是( )| A. | 含有共价键的化合物一定是共价化合物 | |
| B. | 在共价化合物中一定含有共价键 | |
| C. | 含有离子键的化合物一定是离子化合物 | |
| D. | 非极性键也可存在于离子化合物中 |
分析 活泼金属和活泼非金属元素之间易形成离子键,不同非金属元素之间易形成极性键,同种非金属元素之间易形成非极性键,只含共价键的化合物是共价化合物,含有离子键的化合物是离子化合物,离子化合物中可能含有共价键,据此分析解答.
解答 解:A.含有共价键的化合物不一定是共价化合物,可能是离子化合物,如KOH等,故A错误;
B.只含共价键的化合物是共价化合物,所以在共价化合物中一定含有共价键,故B正确;
C.含有离子键的化合物是离子化合物,离子化合物中可能含有共价键,故C正确;
C.非极性键可能存在离子化合物中,如过氧化钠等,故D正确;
故选A.
点评 本题考查化学键和化合物的关系,为高频考点,侧重考查基本概念,明确物质构成微粒及微粒之间作用力是解本题关键,注意离子化合物和共价化合物的区别,题目难度不大.

练习册系列答案
相关题目
7.以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等,用硫酸渣制备铁红(Fe2O3)的过程如下:

(1)酸溶过程中Fe2O3与稀硫酸反应的化学方程式为Fe2O3+3H2SO4═Fe2(SO4)3+3H2O;
“滤渣A”主要成份的化学式为SiO2.
(2)还原过程中加入FeS2的目的是将溶液中的Fe3+还原为Fe2+,而本身被氧化为H2SO4,请完成该反应的离子方程式:FeS2+14Fe3++8H2O═15Fe2++2SO42-+16H+.
(3)氧化过程中,O2、NaOH与Fe2+反应的离子方程式为4Fe2++O2+2H2O+8OH-=4Fe(OH)3↓(或Fe2++2OH-=Fe(OH)2↓,4Fe(OH)2+O2+2H2O=4Fe(OH)3).
(4)为了确保铁红的质量,氧化过程需要调节溶液的pH的范围是3.2~3.8(或之间的数据值)(几种离子沉淀的pH见下表);滤液B可以回收的物质有(写化学式)Na2SO4、Al2(SO4)3、MgSO4.

(1)酸溶过程中Fe2O3与稀硫酸反应的化学方程式为Fe2O3+3H2SO4═Fe2(SO4)3+3H2O;
“滤渣A”主要成份的化学式为SiO2.
(2)还原过程中加入FeS2的目的是将溶液中的Fe3+还原为Fe2+,而本身被氧化为H2SO4,请完成该反应的离子方程式:FeS2+14Fe3++8H2O═15Fe2++2SO42-+16H+.
(3)氧化过程中,O2、NaOH与Fe2+反应的离子方程式为4Fe2++O2+2H2O+8OH-=4Fe(OH)3↓(或Fe2++2OH-=Fe(OH)2↓,4Fe(OH)2+O2+2H2O=4Fe(OH)3).
(4)为了确保铁红的质量,氧化过程需要调节溶液的pH的范围是3.2~3.8(或之间的数据值)(几种离子沉淀的pH见下表);滤液B可以回收的物质有(写化学式)Na2SO4、Al2(SO4)3、MgSO4.
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.8 | 7.6 | 9.4 |
| 完全沉淀pH | 3.2 | 5.2 | 9.7 | 12.4 |
8.生理盐水是指质量分数为0.9%的NaCl溶液.下列有关该溶液说法正确的是( )
| A. | 100g溶液中含有0.9 g NaCl | B. | 100 g水中含有0.9 g NaCl | ||
| C. | 100 g溶液中含有0.9 mol NaCl | D. | 100 g水中含有0.9 mol NaCl |
5.研究表明26Al可以衰变为26Mg,可以比较这两种元素金属性强弱的方法是( )
| A. | 比较这两种元素的单质的硬度和熔点 | |
| B. | 在氯化铝和氯化镁的溶液中分别滴加过量的氨水 | |
| C. | 将打磨过的镁带和铝片分别和热水作用,并滴入酚酞溶液 | |
| D. | 将空气中放置已久的这两种元素的单质分别和热水作用 |
2.环癸五烯的结构简式可表示为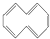 ,下列说法正确的是( )
,下列说法正确的是( )
 ,下列说法正确的是( )
,下列说法正确的是( )| A. | 根据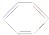 的结构特点可知环癸五烯的分子式为C10H8 的结构特点可知环癸五烯的分子式为C10H8 | |
| B. | 常温常压下环癸五烯是一种易溶于水的无色气体 | |
| C. | 环癸五烯既能使溴水褪色,又能使酸性KMnO4溶液褪色 | |
| D. | 环癸五烯与Cl2的加成产物只有一种 |
6.下列反应过程中的能量变化与如图一致的是( )
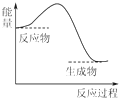

| A. | 2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3 | B. | CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑ | ||
| C. | C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2 | D. | C+CO2$\frac{\underline{\;\;△\;\;}}{\;}$2CO |
7.下列有关物质的性质与应用不相对应的是( )
| A. | 铝的熔点很高,可用于制作耐高温材料 | |
| B. | Na2O2能与水和二氧化碳反应生成氧气,可用于呼吸面具中作为氧气的来源 | |
| C. | 明矾能在天然水中生成Al(OH)3胶体,可用作净水剂 | |
| D. | 用氢氟酸雕刻玻璃,是由于氢氟酸能与二氧化硅反应 |