题目内容
1.在一容积为4L的密闭容器中,加入0.4mol的N2和1.2mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g )△H<0,反应中NH3的物质的量浓度变化情况如图1: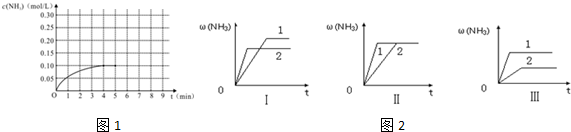
(1)根据图,计算从反应开始到平衡时,平均反应速率v(H2)为0.0375mol/(L•min).
(2)该反应的化学平衡常数表达式K$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})•{c}^{3}({H}_{2})}$,随温度的升高,K值将减小(填“增大”、“减小”“不变”)
(3)反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,则NH3的物质的量浓度不可能为a、c.
a.0.20mol/L b.0.12mol/Lc.0.10mol/L d.0.08mol/L
(4)反应达到平衡后,第5分钟末,保持其它条件不变,若只把容器的体积缩小一半,平衡向正反应方向移动(填“向逆反应方向”、“向正反应方向”或“不”),化学平衡常数不变(填“增大”、“减小”或“不变”).
(5)在第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(此时NH3的浓度约为0.25mol/L),请在图1中画出第5分钟末到此平衡时NH3浓度的变化曲线.
(6)在三个相同容器中各充入1molN2和3molH2,在某一不同条件下反应并达到平衡,氨的体积分数随时间变化曲线如图2.下列说法正确的是D(填序号).
A.图Ⅰ可能是不同压强对反应的影响,且P2>P1
B.图Ⅱ可能是不同压强对反应的影响,且P1>P2
C.图Ⅲ可能是不同温度对反应的影响,且T1>T2
D.图Ⅱ可能是同温同压下,催化剂性能对反应的影响,且1>2.
分析 (1)根据v(H2)=$\frac{3}{2}$c(NH3)进行计算;
(2)化学平衡常数K等于生成物浓度幂之积与反应物浓度幂之积的比,反应N2(g)+3H2(g)?2NH3(g )△H<0正反应为放热反应;
(3)根据反应的可逆性特点以及温度改变平衡一定发生移动进行判断;
(4)体积减小,气体压强增大,平衡向气体体积减小的方向移动,化学平衡常数只与温度有关,温度不变,化学平衡常数不变;
(5)第5分钟末将容器的体积缩小一半后,压强增大,平衡正向移动,氨气的浓度增大,在第8分钟末达到新的平衡时NH3的浓度约为0.25mol•L-1;
(6)A.增大压强平衡右移;
B.压强不同,平衡状态不同;
C.升高温度平衡逆向移动;
D.催化剂不影响平衡移动.
解答 解:(1)根据图象分析平衡时氨气的浓度为0.1mol/L,时间为4min,所以依据速率之比等于系数之比得到:v(H2)=$\frac{3}{2}$v(NH3)=$\frac{3}{2}$×$\frac{0.1mol/L}{4min}$=0.0375 mol/(L•min),故答案为:0.0375 mol/(L•min);
(2)该反应的化学平衡常数K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})•{c}^{3}({H}_{2})}$,反应N2(g)+3H2(g)?2NH3(g )△H<0正反应为放热反应,随温度的升高,平衡逆向移动,平衡常数减小,故答案为:$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})•{c}^{3}({H}_{2})}$;减小;
(3)该反应为可逆反应,反应物不可能完全转化,则NH3的物质的量浓度不可能为0.2mol/L,温度改变平衡一定发生移动,则NH3的物质的量浓度不可能为0.1mol/L,故答案为:a、c;
(4)该反应是气体体积减小的反应,把容器的体积缩小一半,增大了反应体系的压强,增大压强,平衡向气体体积减小的方向移动,即向正反应方向移动;化学平衡常数只与温度有关,温度不变,平衡常数不变,
故答案为:向正反应方向;不变;
(5)第5分钟末将容器的体积缩小一半后,氨气浓度为0.40mol/L,压强增大,平衡正向移动,氨气的浓度增大,在第8分钟末达到新的平衡时NH3的浓度约为0.50mol•L-1,则图象为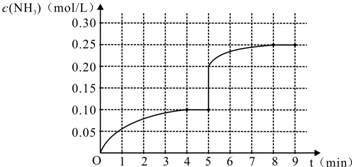 ,故答案为:
,故答案为: ;
;
(6)A.增大压强平衡右移,氨气的含量应增大,故A错误;
B.压强不同,平衡状态不同,不可能在同一平衡状态,故B错误;
C.升高温度平衡逆向移动,氨气的含量减小,故C错误;
D.催化剂不影响平衡移动,由图象可知催化剂性能,1>2,故D正确.
故答案为:D.
点评 本题考查化学平衡的计算,明确反应速率计算、平衡的影响因素及图象的分析试剂解答本题的关键,题目难度中等,难点是(5)题图象,注意缩小体积瞬间,氨气浓度变为原来的2倍,为易错点.

 阅读快车系列答案
阅读快车系列答案| A. | Fe2O3(Al2O3)用盐酸 | B. | Fe2O3(Al2O3)用氨水 | ||
| C. | Mg(Al)用纯碱溶液 | D. | MgCl2(AlCl3)用氢氧化钠溶液和盐酸 |
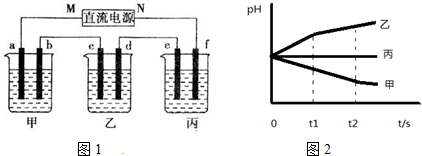
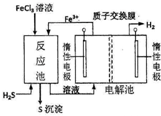 现代工业生产中常用电解氯化亚铁的方法制得氯化铁溶液吸收有毒的硫化氢气体.工艺原理如图所示.下列说法中不正确的是( )
现代工业生产中常用电解氯化亚铁的方法制得氯化铁溶液吸收有毒的硫化氢气体.工艺原理如图所示.下列说法中不正确的是( )| A. | 左槽中发生的反应是:2Cl--2e-═Cl2↑ | |
| B. | 右槽中的反应式:2H++2 e-═H2↑ | |
| C. | H+从电解池左槽迁移到右槽 | |
| D. | FeCl3溶液可以循环利用 |
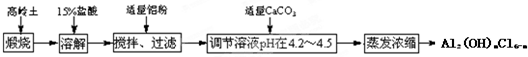
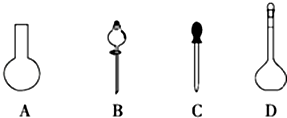
(1)若用Na2S2O3固体来配制标准溶液,在如图所示的仪器中,不必要用到的仪器是AB(填字母),还缺少的玻璃仪器是烧杯、玻璃杯(填仪器名称).
(2)根据计算需用天平称取Na2S2O3固体的质量是15.8g.在实验中其他操作均正确,若容量瓶用蒸馏水洗涤后未干燥,则所得溶液浓度=(填“>”“<”或“=”,下同)0.2000mol•L-1.若还未等溶液冷却就定容了,则所得溶液浓度>0.2000mol•L-1.
(3)用滴定法标定的具体方法:量取20.00mL NaClO溶液于锥形瓶中,加入适量稀盐酸和足量KI固体,用0.2000mol•L -1 Na2S2O3标准溶液滴定至终点(淀粉溶液作指示剂),四次平行实验测定的V(Na2S2O3)数据如下:
(已知:I2+2Na2S2O3═2NaI+Na2S4O6)
| 测定次序 | 第一次 | 第二次 | 第三次 | 第四次 |
| V(Na2S2O3)/mL | 21.90 | 18.80 | 22.10 | 22.00 |
②NaClO溶液的物质的量浓度是0.1060mol/L.
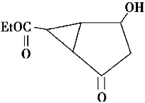 及其核磁共振氢谱图如下:下列关于该有机物的叙述正确的是( )
及其核磁共振氢谱图如下:下列关于该有机物的叙述正确的是( )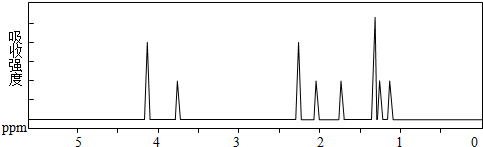
| A. | 该有机物不同化学环境的氢原子有6种 | |
| B. | 该有机物属于芳香族化合物 | |
| C. | 键线式中的Et代表的基团为-CH3 | |
| D. | 该有机物的分子式为C9H12O4 |
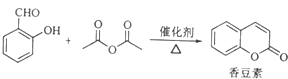
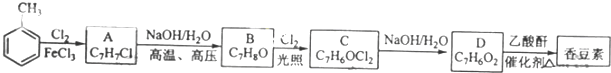
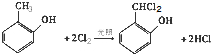 ;
; (写结构简式)
(写结构简式)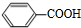 (写结构简式)
(写结构简式)