题目内容
6.两中不同浓度的NaOH溶液,c(H+)分别为1.0×10-14mol•L-1和1.0×10-10mol•L-1,将这两种溶液等体积混合后,所得溶液的c(H+)是多少?分析 根据Kw计算溶液中c(OH-),然后求出混合后溶液中c(OH-),再求出c(H+).
解答 解:NaOH溶液,c(H+)分别为1.0×10-14mol•L-1和1.0×10-10mol•L-1,则c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-14}}$=1mol/L,c′(OH-)=$\frac{1{0}^{-14}}{1{0}^{-10}}$=10-4mol/L,
这两种溶液等体积混合后c(OH-)=$\frac{1+1{0}^{-4}}{2}$=0.5mol/L,c(H+)=$\frac{1{0}^{-14}}{0.5}$=2.0×10-14mol•L-1;
答:所得溶液的c(H+)是2.0×10-14mol•L-1.
点评 本题考查了溶液中氢离子浓度的计算,题目难度不大,侧重于考查学生的分析能力和计算能力,注意把握Kw=c(H+)×c(OH-)的应用.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
17.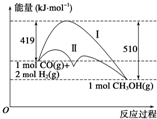 利用含碳化合物合成燃料是解决能源危机的重要方法,已知CO(g)+2H2(g)?CH3OH(g)反应过程中的能量变化情况如图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况.下列判断正确的是( )
利用含碳化合物合成燃料是解决能源危机的重要方法,已知CO(g)+2H2(g)?CH3OH(g)反应过程中的能量变化情况如图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况.下列判断正确的是( )
 利用含碳化合物合成燃料是解决能源危机的重要方法,已知CO(g)+2H2(g)?CH3OH(g)反应过程中的能量变化情况如图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况.下列判断正确的是( )
利用含碳化合物合成燃料是解决能源危机的重要方法,已知CO(g)+2H2(g)?CH3OH(g)反应过程中的能量变化情况如图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况.下列判断正确的是( )| A. | 该反应的△H=+91 kJ•mol-1 | |
| B. | 加入催化剂,该反应的△H变小 | |
| C. | 反应物的总能量小于生成物的总能量 | |
| D. | 如果该反应生成液态CH3OH,则△H减小 |
14.实验室用NaOH固体配制480mL0.2mol•L-1的NaOH溶液.清回答下列问题:
(l)配制480mL0.2mol•L-1的NaOH溶液
(2)容量瓶需标有以下五项中的①③⑤,
①温度 ②浓度 ③容量 ④压强 ⑤刻度线
(3)配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次)BCAFED;并完成横线上的内容.
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
B.用天平准确称取所需质量的NaOH,放入烧杯,加入少量水(约30mL),用玻璃棒慢慢搅拌,使其充分溶解
C.将已冷却的NaOH溶液沿玻璃棒注入250mL的容量瓶中
D.将容量瓶盖紧,颠倒摇匀
E.改用胶头滴管加水,使溶液凹液面最低处与刻度线相切.
F.继续往容量瓶内小心加水,眼睛注视凹液面最低处,直到液面接近刻度1~2cm处
(4)在配制上述溶液实验中,下列操作引起结果(浓度)偏低的有ABC(填序号).
A.在烧杯中稀释溶质搅拌时,溅出少量溶液
B.没有用蒸馏水洗烧杯2~3次,未将洗液移人容量瓶中
C.定容时,加水超过了刻度线,倒出一些再重新加水到刻度线
D.将所配溶液从容量瓶转移到试剂瓶时,有少量溅出
E.容量瓶刚用蒸馏水洗净,没有烘干.
(l)配制480mL0.2mol•L-1的NaOH溶液
| 应称取NaOH的质量/g | 应选用容量瓶的规格/mL | 除容量瓶外还需要的其他玻璃仪器 |
①温度 ②浓度 ③容量 ④压强 ⑤刻度线
(3)配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次)BCAFED;并完成横线上的内容.
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
B.用天平准确称取所需质量的NaOH,放入烧杯,加入少量水(约30mL),用玻璃棒慢慢搅拌,使其充分溶解
C.将已冷却的NaOH溶液沿玻璃棒注入250mL的容量瓶中
D.将容量瓶盖紧,颠倒摇匀
E.改用胶头滴管加水,使溶液凹液面最低处与刻度线相切.
F.继续往容量瓶内小心加水,眼睛注视凹液面最低处,直到液面接近刻度1~2cm处
(4)在配制上述溶液实验中,下列操作引起结果(浓度)偏低的有ABC(填序号).
A.在烧杯中稀释溶质搅拌时,溅出少量溶液
B.没有用蒸馏水洗烧杯2~3次,未将洗液移人容量瓶中
C.定容时,加水超过了刻度线,倒出一些再重新加水到刻度线
D.将所配溶液从容量瓶转移到试剂瓶时,有少量溅出
E.容量瓶刚用蒸馏水洗净,没有烘干.
1.有关热化学方程式书写与对应表述均正确的是( )
| A. | 已知2C(s)+O2(g)=2CO(g)△H=-221 kJ•mol-1,则可知C的标准燃烧热为110.5 kJ•mol-1 | |
| B. | 在101KPa下氢气的标准燃烧热△H=-285.5 kJ•mol-1,则水分解的热化学方程式:2H2O(l)=2H2(g)+O2(g)△H=+285.5 kJ•mol-1 | |
| C. | 稀硫酸与0.1 mol/LNaOH溶液反应:H+(aq)+OH-(aq)=H2O(l)△H=-57.3 kJ•mol-1 | |
| D. | 密闭容器中,9.6 g硫粉与11.2 g铁粉混合加热生成硫化亚铁17.6 g时,放出19.12 kJ热量.则Fe(s)+S(g)=FeS(s)△H=-95.6 kJ•mol-1 |
11.将5g 镁、锌、铁三种金属的混合物投入40mL稀硫酸中,恰好完全反应,生成的氢气在标准状况下的体积是2.8L,则这三种金属的物质的量之和为( )
| A. | 0.25mol | B. | 0.125mol | C. | 0.1mol | D. | 0.5mol |
18.下列说法不正确的是( )
| A. | 用激光笔检验豆浆的丁达尔现象 | |
| B. | 胶体的分散质粒子直径小于l00nm但大于1nm,能通过滤纸,不能透过半透膜 | |
| C. | 存在自由移动的离子是电解质溶液导电的原因 | |
| D. | 用萃取的方法分离汽油和煤油 |
4.某化学研究性学习小组通过查阅资料,设计了如下图所示的方法以含镍废催化剂为原料来制备NiSO4•7H2O.已知某化工厂的含镍催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%).

部分阳离子以氢氧化物形式开始沉淀和完全沉淀时的pH如下:
回答下列问题:
(1)操作a、c中需使用的仪器除铁架台(带铁圈)、酒精灯、烧杯、玻璃棒外还需要的两种仪器为漏斗、蒸发皿.
(2)“碱浸”过程中发生的离子方程式是2Al+2OH-+2H2O═2AlO2-+3H2↑、Al2O3+2OH-═2AlO2-+H2O.
“酸浸”时所加入的酸是H2SO4(填化学式).酸浸后,经操作a分离出固体①后,溶液中可能含有的金属离子是Ni2+、Fe2+.
(3)调节溶液PH为2~3的目的是防止在浓缩结晶过程中Ni2+水解.
(4)产品晶体中有时会混有少量绿矾(FeSO4•7H2O),其原因可能是H2O2的用量不足(或H2O2失效)、保温时间不足导致Fe2+未被完全氧化造成的.(回答一点即可)
(5)现有100千克含镍催化剂,如果酸浸步骤镍浸出率为a%,其它物质全部参与反应,且假定镍在酸浸后续步骤无损失.操作C后粗晶体中含绿矾b%,则最终能得到粗晶体$\frac{100×64.4%×a%×281}{(1-b%)×59}$千克(Ni-59 NiSO4•7H2O-281)(只要求写出计算表达式).若要进一步提纯晶体,需进行的操作是重结晶.

部分阳离子以氢氧化物形式开始沉淀和完全沉淀时的pH如下:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| 开始沉淀pH | 3.4 | 1.8 | 7.5 | 7.2 |
| 完全沉淀pH | 5.2 | 3.2 | 9.7 | 9.2 |
(1)操作a、c中需使用的仪器除铁架台(带铁圈)、酒精灯、烧杯、玻璃棒外还需要的两种仪器为漏斗、蒸发皿.
(2)“碱浸”过程中发生的离子方程式是2Al+2OH-+2H2O═2AlO2-+3H2↑、Al2O3+2OH-═2AlO2-+H2O.
“酸浸”时所加入的酸是H2SO4(填化学式).酸浸后,经操作a分离出固体①后,溶液中可能含有的金属离子是Ni2+、Fe2+.
(3)调节溶液PH为2~3的目的是防止在浓缩结晶过程中Ni2+水解.
(4)产品晶体中有时会混有少量绿矾(FeSO4•7H2O),其原因可能是H2O2的用量不足(或H2O2失效)、保温时间不足导致Fe2+未被完全氧化造成的.(回答一点即可)
(5)现有100千克含镍催化剂,如果酸浸步骤镍浸出率为a%,其它物质全部参与反应,且假定镍在酸浸后续步骤无损失.操作C后粗晶体中含绿矾b%,则最终能得到粗晶体$\frac{100×64.4%×a%×281}{(1-b%)×59}$千克(Ni-59 NiSO4•7H2O-281)(只要求写出计算表达式).若要进一步提纯晶体,需进行的操作是重结晶.
