题目内容
14.实验室用NaOH固体配制480mL0.2mol•L-1的NaOH溶液.清回答下列问题:(l)配制480mL0.2mol•L-1的NaOH溶液
| 应称取NaOH的质量/g | 应选用容量瓶的规格/mL | 除容量瓶外还需要的其他玻璃仪器 |
①温度 ②浓度 ③容量 ④压强 ⑤刻度线
(3)配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次)BCAFED;并完成横线上的内容.
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
B.用天平准确称取所需质量的NaOH,放入烧杯,加入少量水(约30mL),用玻璃棒慢慢搅拌,使其充分溶解
C.将已冷却的NaOH溶液沿玻璃棒注入250mL的容量瓶中
D.将容量瓶盖紧,颠倒摇匀
E.改用胶头滴管加水,使溶液凹液面最低处与刻度线相切.
F.继续往容量瓶内小心加水,眼睛注视凹液面最低处,直到液面接近刻度1~2cm处
(4)在配制上述溶液实验中,下列操作引起结果(浓度)偏低的有ABC(填序号).
A.在烧杯中稀释溶质搅拌时,溅出少量溶液
B.没有用蒸馏水洗烧杯2~3次,未将洗液移人容量瓶中
C.定容时,加水超过了刻度线,倒出一些再重新加水到刻度线
D.将所配溶液从容量瓶转移到试剂瓶时,有少量溅出
E.容量瓶刚用蒸馏水洗净,没有烘干.
分析 (1)依据配制溶液体积选择容量瓶规格,依据m=CVM计算需要溶质的质量;依据配制一定物质的量浓度一般步骤选择需要仪器;
(2)根据容量瓶的构造解答;
(3)配制一定物质的量浓度溶液一般步骤为:计算、称量、溶解、移液、洗涤、定容、摇匀、装瓶贴标签,据此排序;容量瓶瓶颈较细,移液应用玻璃棒引流;定容时,继续往容量瓶内小心加水,眼睛注视凹液面最低处,最后用胶头滴管逐滴滴加水到凹液面最低处于刻度线相切;
(4)分析操作对溶质的物质的量和溶液体积的影响,依据c=$\frac{n}{V}$进行误差分析.
解答 解:(1)配制480mL0.2mol•L-1的NaOH溶液,实验室没有480mL容量瓶,应选择500mL容量瓶,实际配制500mL溶液,需要溶质的质量=0.2mol/L×40g/mol×0.5L=4.0g;
配制一定物质的量浓度溶液一般步骤为:计算、称量、溶解、移液、洗涤、定容、摇匀,用到的仪器:托盘天平、药匙、烧杯、玻璃棒、500mL容量瓶、胶头滴管,所以还需要的玻璃仪器:烧杯、玻璃棒、胶头滴管;
故答案为:4.0; 500mL容量瓶; 烧杯、玻璃棒、胶头滴管;
(2)容量瓶的定量仪器,所以标有容积和刻度,温度影响溶液的体积,所以容量瓶上还标有使用的温度;
故选:①③⑤;
(3)配制一定物质的量浓度溶液一般步骤为:计算、称量、溶解、移液、洗涤、定容、摇匀、装瓶贴标签,所以正确的顺序为:BCAFED;
C.容量瓶瓶颈较细,移液应用玻璃棒引流,故答案为:玻璃棒;
E.定容时,最后用胶头滴管逐滴滴加水到凹液面最低处与刻度线相切;
F.定容时,继续往容量瓶内小心加水,眼睛注视凹液面最低处;
故答案为:凹液面最低处与刻度线相切;凹液面最低处;
(4)A.在烧杯中稀释溶质搅拌时,溅出少量溶液,导致溶质部分损耗,溶质的物质的量偏小,溶液浓度偏低,故A选;
B.没有用蒸馏水洗烧杯2~3次,未将洗液移人容量瓶中,导致质部分损耗,溶质的物质的量偏小,溶液浓度偏低,故B选;
C.定容时,加水超过了刻度线,倒出一些再重新加水到刻度线,导致溶液体积偏大,溶液浓度偏低,故C不选;
D.溶液具有均一性,将所配溶液从容量瓶转移到试剂瓶时,有少量溅出,溶液浓度不变,故D不选;
E.容量瓶刚用蒸馏水洗净,没有烘干,对溶质的物质的量和溶液体积都不产生影响,溶液浓度不变,故E不选;
故选:ABC.
点评 本题考查了配制一定物质的量浓度的溶液的方法及误差分析,明确配制原理及操作步骤是解题关键,侧重对学生能力的培养和解题方法的指导和训练,题目难度不大.

| A. | 物质发生化学反应都伴随着能量的变化,伴有能量变化的物质变化都是化学变化 | |
| B. | 101kPa时,2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1,H2(g)的燃烧热为285.8kJ•mol-1 | |
| C. | 在相同条件下的稀溶液中,1molHCl、1molHNO3分别与足量NaOH充分反应,放出的热量相等 | |
| D. | H2+Cl2═2HCl的能量变化情况可用如图表示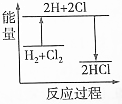 |

可能用到的有关数据列表如下:
| 物 质 | 熔点/℃ | 沸点/℃ | 密度(20℃)/g•cm-3 | 溶解性 |
| 苯 | 5.5 | 80 | 0.88 | 微溶于水 |
| 硝基苯 | 5.7 | 210.9 | 1.205 | 难溶于水 |
| 浓硝酸 | - | 83 | 1.4 | 易溶于水 |
| 浓硫酸 | - | 338 | 1.84 | 易溶于水 |
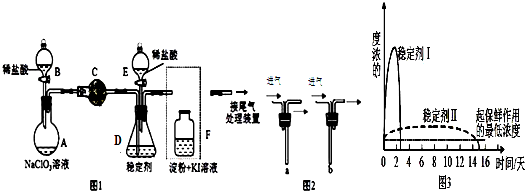
(1)配制混酸应在烧杯中先加入浓硝酸;实验装置中长玻璃管最好用球形冷凝管(或蛇形冷凝管)代替(填仪器名称);恒压滴液漏斗的优点是使混合酸能顺利流下.
(2)反应温度控制在50~60℃的原因是防止副反应发生;反应结束后产物在下层(填“上”或者“下”),步骤②分离混酸和产品的操作名称是分液.
(3)用Na2CO3溶液洗涤之后再用蒸馏水洗涤时,怎样验证液体已洗净?取最后一次洗涤液,向溶液中加入氯化钙,无沉淀生成,说明已洗净.
(4)固体D的名称为无水氯化钙或无水硫酸镁.
(5)用铁粉、稀盐酸与硝基苯(用Ph-NO2表示 )反应可生成染料中间体苯胺(Ph-NH2),其反应的化学方程式为C6H5NO2+3Fe+6HCl→C6H5NH2+3FeCl2+2H2O.
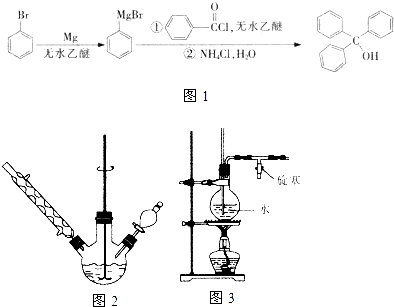 三苯甲醇是一种重要有机合成中间体,可以通过下列原理进行合成:实验步骤如下:
三苯甲醇是一种重要有机合成中间体,可以通过下列原理进行合成:实验步骤如下: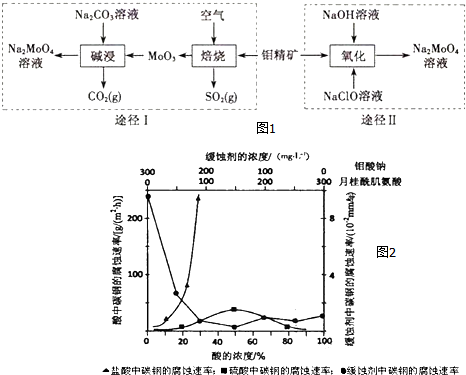
 .
.