题目内容
15.将0.1mol/L盐酸溶液和0.12mol/L氢氧化钠溶液等体积混合,计算混合后溶液的pH.分析 将0.1mol/L盐酸溶液和0.12mol/L氢氧化钠溶液等体积混合,NaOH过量,根据混合后溶液中的c(OH-)=$\frac{n(O{H}^{-})-n({H}^{+})}{{V}_{混}}$,然后根据溶液中的c(H+)=$\frac{Kw}{c(O{H}^{-})}$来计算出氢离子浓度,并根据溶液的pH=-lgc(H+)计算.
解答 解:将0.1mol/L盐酸溶液和0.12mol/L氢氧化钠溶液等体积混合,NaOH过量,则混合后溶液中的c(OH-)=$\frac{n(O{H}^{-})-n({H}^{+})}{{V}_{混}}$=$\frac{0.12mol/L×V-0.1mol/L×V}{2V}$=0.01mol/L,故溶液中的c(H+)=$\frac{Kw}{c(O{H}^{-})}$=$\frac{1{0}^{-14}}{0.01}$=10-12mol/L,则溶液的pH=-lgc(H+)=12.
答:混合后溶液的pH为12.
点评 本题考查了酸碱混合后溶液pH的计算,题目难度中等,明确判断酸碱混合的定性判断及pH的计算方法为解答关键,注意掌握溶液pH的概念及表达式,试题培养了学生的化学计算能力.

练习册系列答案
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案
相关题目
20.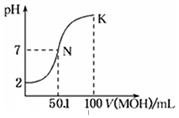 常温下,向100mL 0.01mol•L-1HA溶液中逐滴加入0.02mol•L-1MOH溶液,图中所示曲线表示,混合溶液的pH变化情况(溶液体积变化忽略不计).下列说法中,不正确的是( )
常温下,向100mL 0.01mol•L-1HA溶液中逐滴加入0.02mol•L-1MOH溶液,图中所示曲线表示,混合溶液的pH变化情况(溶液体积变化忽略不计).下列说法中,不正确的是( )
 常温下,向100mL 0.01mol•L-1HA溶液中逐滴加入0.02mol•L-1MOH溶液,图中所示曲线表示,混合溶液的pH变化情况(溶液体积变化忽略不计).下列说法中,不正确的是( )
常温下,向100mL 0.01mol•L-1HA溶液中逐滴加入0.02mol•L-1MOH溶液,图中所示曲线表示,混合溶液的pH变化情况(溶液体积变化忽略不计).下列说法中,不正确的是( )| A. | HA的电离方程式为:HA=H++A- | |
| B. | MOH为一元弱碱 | |
| C. | K点对应的溶液中有:c(MOH)+c(M+)=0.02mol•L-1 | |
| D. | N点对应的溶液中有:c(M+)=c(A-) |
7.下列分类或归类不正确的是( )①蓝矾、液态氯化氢、冰水混合物均为纯净物②Mn2O7、P2O5、SO3、CO2均属于酸性氧化物③明矾、烧碱、硫酸钡均为强电解质④C60、金刚石、石墨均为碳的同素异形体⑤蛋白质溶液、淀粉溶液、雾、墨水均为胶体.
| A. | 无 | B. | ①②⑤ | C. | ①②④⑤ | D. | ①②③ |
12.硝基苯是重要的化工原料,用途广泛.制备反应如下:组装如图1反应装置. 制备、提纯硝基苯流程如图2:

可能用到的有关数据列表如下:
请回答下列问题:
(1)配制混酸应在烧杯中先加入浓硝酸;实验装置中长玻璃管最好用球形冷凝管(或蛇形冷凝管)代替(填仪器名称);恒压滴液漏斗的优点是使混合酸能顺利流下.
(2)反应温度控制在50~60℃的原因是防止副反应发生;反应结束后产物在下层(填“上”或者“下”),步骤②分离混酸和产品的操作名称是分液.
(3)用Na2CO3溶液洗涤之后再用蒸馏水洗涤时,怎样验证液体已洗净?取最后一次洗涤液,向溶液中加入氯化钙,无沉淀生成,说明已洗净.
(4)固体D的名称为无水氯化钙或无水硫酸镁.
(5)用铁粉、稀盐酸与硝基苯(用Ph-NO2表示 )反应可生成染料中间体苯胺(Ph-NH2),其反应的化学方程式为C6H5NO2+3Fe+6HCl→C6H5NH2+3FeCl2+2H2O.

可能用到的有关数据列表如下:
| 物 质 | 熔点/℃ | 沸点/℃ | 密度(20℃)/g•cm-3 | 溶解性 |
| 苯 | 5.5 | 80 | 0.88 | 微溶于水 |
| 硝基苯 | 5.7 | 210.9 | 1.205 | 难溶于水 |
| 浓硝酸 | - | 83 | 1.4 | 易溶于水 |
| 浓硫酸 | - | 338 | 1.84 | 易溶于水 |
(1)配制混酸应在烧杯中先加入浓硝酸;实验装置中长玻璃管最好用球形冷凝管(或蛇形冷凝管)代替(填仪器名称);恒压滴液漏斗的优点是使混合酸能顺利流下.
(2)反应温度控制在50~60℃的原因是防止副反应发生;反应结束后产物在下层(填“上”或者“下”),步骤②分离混酸和产品的操作名称是分液.
(3)用Na2CO3溶液洗涤之后再用蒸馏水洗涤时,怎样验证液体已洗净?取最后一次洗涤液,向溶液中加入氯化钙,无沉淀生成,说明已洗净.
(4)固体D的名称为无水氯化钙或无水硫酸镁.
(5)用铁粉、稀盐酸与硝基苯(用Ph-NO2表示 )反应可生成染料中间体苯胺(Ph-NH2),其反应的化学方程式为C6H5NO2+3Fe+6HCl→C6H5NH2+3FeCl2+2H2O.
 .
.