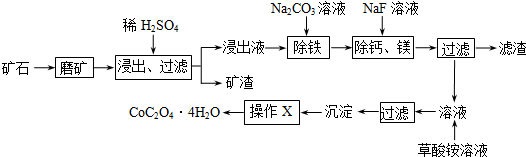
题目内容
有A、B两容器,均装入铁和热浓硝酸,A容器中有1mol铁被氧化,B容器中有1mol硝酸被还原,则A、B两容器中所放出的NO2的物质的量之比为 .
考点:化学方程式的有关计算
专题:
分析:氧化还原反应中,化合价升高的物质作还原剂,还原剂发生氧化反应,生成的产物为氧化产物,化合价降低的物质作氧化剂,氧化剂发生还原反应,生成的产物为还原产物;
Fe+6HNO3(浓)
Fe(NO3)3+3NO2↑+3H2O中,Fe元素的化合价由0升高为+3价,硝酸中N元素的化合价由+5价降低为+4价,1molFe被氧化,被还原的硝酸为3mol,或根据得失电子守恒解答,以此计算.
Fe+6HNO3(浓)
| ||
解答:
解:Fe+6HNO3(浓)
Fe(NO3)3+3NO2↑+3H2O,该反应中元素的化合价变化如下:3Fe→3Fe(NO3)3,Fe元素的化合价由0价→+3价,Fe失去3e-; 3HNO3→3NO2,N元素的化合价由+5价→+4价,得到3e-,化合价降低的物质作氧化剂,所以该反应的氧化剂是硝酸,化合价升高的物质作还原剂,铁为还原剂,
方法一:A容器中有1mol铁被氧化,根据方程式放出的NO2的物质的量n(NO2)=3n(Fe)=3mol,
1molFe被氧化,被还原的硝酸为3mol,B容器中有1mol硝酸被还原,参加反应的铁为
mol,放出的NO2的物质的量n(NO2)=3n(Fe)=1mol,则A、B两容器中所放出的NO2的物质的量之比为3:1,
方法二:由电子守恒可知,铁元素失去的电子总数等于氮元素得到的电子总数,所以
A容器中有1mol铁被氧化,Fe元素的化合价由0价→+3价,失去3mole-; N元素的化合价由+5价→+4价,得到e-,所以生成的二氧化氮的物质的量为3mol;
N元素的化合价由+5价→+4价,B容器中有1mol硝酸被还原,得到1mole-,所以生成的二氧化氮的物质的量为1mol;
则A、B两容器中所放出的NO2的物质的量之比为3:1,
故答案为:3:1;
| ||
方法一:A容器中有1mol铁被氧化,根据方程式放出的NO2的物质的量n(NO2)=3n(Fe)=3mol,
1molFe被氧化,被还原的硝酸为3mol,B容器中有1mol硝酸被还原,参加反应的铁为
| 1 |
| 3 |
方法二:由电子守恒可知,铁元素失去的电子总数等于氮元素得到的电子总数,所以
A容器中有1mol铁被氧化,Fe元素的化合价由0价→+3价,失去3mole-; N元素的化合价由+5价→+4价,得到e-,所以生成的二氧化氮的物质的量为3mol;
N元素的化合价由+5价→+4价,B容器中有1mol硝酸被还原,得到1mole-,所以生成的二氧化氮的物质的量为1mol;
则A、B两容器中所放出的NO2的物质的量之比为3:1,
故答案为:3:1;
点评:本题考查氧化还原反应计算、氧化还原反应概念,为高频考点,把握反应中元素的化合价变化为解答的关键,注意根据产物中化合价判断起氧化剂与还原剂与NO2物质的量之间的关系,题目难度中等.

练习册系列答案
 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案
相关题目
下列有关物质的性质与应用相对应的是( )
| A、稀硝酸具有氧化性,可用于清洗做银镜反应的试管 |
| B、BaSO4、BaCO3均难溶于水,都可用作钡餐 |
| C、铝合金的大量使用归功于人们能用焦炭等还原剂从氧化铝中获取铝 |
| D、加热盛有NH4Cl固体的试管,管口有固体凝结,这是升华现象 |
能正确表示下列反应的离子方程式为( )
| A、大理石溶于盐酸中:CO32-+2H+=CO2↑+H2O |
| B、氯化铝加到过量氢氧化钠溶液中:Al3++4OH-=[Al(OH)4]- |
| C、(NH4)2CO3溶液中加入过量Ba(OH)2溶液:NH4++OH-=NH3↑+H2O |
| D、氯化铁溶液中加入铜片:Fe3++Cu=Fe2++Cu2+ |
下列说法或描述中,不符合实际的是( )
| A、医用药品应在低温、干燥的环境下密封保存 |
| B、反应中的某一物质的转化率α(B)增大,则该反应的平衡常数K一定增大 |
| C、向一堆篝火“鼓风”,有助于它继续燃烧下去 |
| D、微量的MnO2粉末可以使过氧化氢快速分解,而MnO2的质量在反应前后并没发生变化 |
下列有关化学键的叙述,正确的是( )
| A、离子化合物中不一定含有离子键 |
| B、单质分子中均不存在化学键 |
| C、由C元素形成的单质不一定是原子晶体 |
| D、含有共价键的化合物一定是共价化合物 |