题目内容
(1)实验室中所用的氧化钢(CuO)是黑色粉末.在使用电烙铁时,其头部是一铜制的烙铁头,长期使用,表面被氧化,但脱落下来的氧化膜却是红色的,试说明原因.
(2)法医鉴定砷中毒(通常为砒霜)的方法是用锌、盐酸和试样混在一起,将生成的气体导入热玻璃管,如果试样中有砷化物存在,则在玻璃管的壁上出现亮黑色的“砷镜”.试写出有关的反应式.
(3)把CO2气体通入澄清的石灰水,立即会产生浑浊,但把SO2气体通入澄清的石灰水,却不容易看那浑浊,而CaCO3和CaSO3都是难溶的电解质,试说明原因.
(2)法医鉴定砷中毒(通常为砒霜)的方法是用锌、盐酸和试样混在一起,将生成的气体导入热玻璃管,如果试样中有砷化物存在,则在玻璃管的壁上出现亮黑色的“砷镜”.试写出有关的反应式.
(3)把CO2气体通入澄清的石灰水,立即会产生浑浊,但把SO2气体通入澄清的石灰水,却不容易看那浑浊,而CaCO3和CaSO3都是难溶的电解质,试说明原因.
考点:铜金属及其重要化合物的主要性质,二氧化硫的化学性质
专题:元素及其化合物
分析:(1)氧化铜在高温下分解为氧化亚铜和氧气;
(2)根据题目信息砒霜、锌粉和盐酸为反应物,生成物之一为AsH3,根据质量守恒定律可写出反应的化学方程式;
(3)根据SO2在水中的溶解度比CO2大得多,而且H2SO4的酸性比H2CO3强得多来分析.
(2)根据题目信息砒霜、锌粉和盐酸为反应物,生成物之一为AsH3,根据质量守恒定律可写出反应的化学方程式;
(3)根据SO2在水中的溶解度比CO2大得多,而且H2SO4的酸性比H2CO3强得多来分析.
解答:
解:(1)氧化铜在高温下分解为氧化亚铜和氧气,氧化亚铜是红色的物质,Cu2O比CuO稳定,答:因为Cu2O比CuO稳定,在加热条件下总是生成红色的Cu2O;
(2)根据题目信息砒霜、锌粉和盐酸为反应物,生成物之一为AsH3,根据质量守恒定律可写出反应的化学方程式As2O3+12HCl+6Zn=6ZnCl2+2AsH3↑+3H2O,2AsH3
2As+3H2,
故答案为:As2O3+6Zn+12HCl=2AsH3↑+6ZnCl2+3H2O;2AsH3
2As+3H2;
(3)因为SO2在水中的溶解度比CO2大得多,而且H2SO3的酸性比H2CO3强得多,所以通SO2于澄清的石灰水中极易过量,过量后生成Ca(HSO3)2而溶解,
答:SO2在水中的溶解度比CO2大得多,而且H2SO3的酸性比H2CO3强得多,所以通SO2于澄清的石灰水中极易过量,过量后生成Ca(HSO3)2而溶解,不容易看到浑浊.
(2)根据题目信息砒霜、锌粉和盐酸为反应物,生成物之一为AsH3,根据质量守恒定律可写出反应的化学方程式As2O3+12HCl+6Zn=6ZnCl2+2AsH3↑+3H2O,2AsH3
| ||
故答案为:As2O3+6Zn+12HCl=2AsH3↑+6ZnCl2+3H2O;2AsH3
| ||
(3)因为SO2在水中的溶解度比CO2大得多,而且H2SO3的酸性比H2CO3强得多,所以通SO2于澄清的石灰水中极易过量,过量后生成Ca(HSO3)2而溶解,
答:SO2在水中的溶解度比CO2大得多,而且H2SO3的酸性比H2CO3强得多,所以通SO2于澄清的石灰水中极易过量,过量后生成Ca(HSO3)2而溶解,不容易看到浑浊.
点评:本题综合考查学生物质的性质以及二氧化硫、二氧化碳性质的区别知识,注意知识的迁移和应用是关键,难度中等.

练习册系列答案
相关题目
铜粉放入稀硫酸中,加热后无现象,当加入一种盐后,铜粉的质量减少,溶液变蓝,同时有气体产生,此盐应是( )
| A、氯化钾 | B、硫酸钾 |
| C、硝酸钾 | D、硫酸铵 |
 北京市疾病预防控制中心的调查结果显示,在北京市场上有九成受检香水和三成护发类化妆品被查出致癌物“邻苯二甲酸酯”(PAEs),值得注意的是,在儿童护肤类化妆品中亦有两件样品分别被检出邻苯二甲酸二乙酯(DEP)和邻苯二甲酸二(2-乙基己基)酯(DEHP).
北京市疾病预防控制中心的调查结果显示,在北京市场上有九成受检香水和三成护发类化妆品被查出致癌物“邻苯二甲酸酯”(PAEs),值得注意的是,在儿童护肤类化妆品中亦有两件样品分别被检出邻苯二甲酸二乙酯(DEP)和邻苯二甲酸二(2-乙基己基)酯(DEHP).

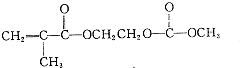
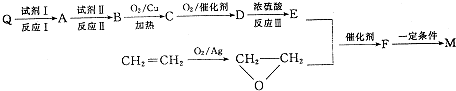
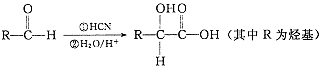
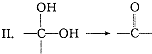
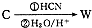 ,请写出符合下列条件的w的一种同分异构体的结构简式
,请写出符合下列条件的w的一种同分异构体的结构简式