题目内容
X、Y、Z、U、V、W、R七种短周期元素原子序数依次增大,且X和Y同周期,X的低价氧化物与Y单质分子的电子总数相等;Z、V、W的最高价氧化物的水化物两两相互反应.根据以上信息填空:
(1)V原子的结构示意图 ;Y的气态氢化物电子式为 .
(2)Y的最高价氧化物对应的水化物的稀溶液与U的单质反应时,Y被还原到最低价,该反应的化学方程式是 .
(3)标准状况下4.48L X的最高价氧化物通入200mL 2mol/L Z的碳酸正盐溶液中,充分反应后,所得溶液中离子浓度由大到小顺序是 .
(4)常温下R单质与Z的最高价氧化物对应水化物反应的离子方程式: .
(5)Z、W构成的高能电池(Na2O和Al2O3为电解质)在320℃左右发生的电池反应为2Z+aW═Z2Wa,正极的电极反应式为 .与铅蓄电池相比,当消耗相同质量的负极活性物质时,该电池的理论放电量是铅蓄电池的 倍.
(1)V原子的结构示意图
(2)Y的最高价氧化物对应的水化物的稀溶液与U的单质反应时,Y被还原到最低价,该反应的化学方程式是
(3)标准状况下4.48L X的最高价氧化物通入200mL 2mol/L Z的碳酸正盐溶液中,充分反应后,所得溶液中离子浓度由大到小顺序是
(4)常温下R单质与Z的最高价氧化物对应水化物反应的离子方程式:
(5)Z、W构成的高能电池(Na2O和Al2O3为电解质)在320℃左右发生的电池反应为2Z+aW═Z2Wa,正极的电极反应式为
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:X、Y、Z、U、V、W、R是7种短周期主族元素,其原子序数依次增大,且X和Y同周期,X的低价氧化物与Y单质分子的电子总数相等,则X为C元素,Y为N元素;Z、V、W的最高价氧化物的水化物两两相互反应,又最高价氧化物的水化物不是酸就是碱,则Z、V、W的最高价氧化物的水化物中必定有个显两性,故只有氢氧化铝显两性,又X、Y、Z、U、V、W、R是7种短周期主族元素,其原子序数依次增大,故Z为Na元素,V为Al元素,W为S元素;再根据X、Y、Z、U、V、W、R是7种短周期主族元素,其原子序数依次增大,则U为Mg元素,R为Cl元素据此解答.
解答:
解:X、Y、Z、U、V、W、R是7种短周期主族元素,其原子序数依次增大,且X和Y同周期,X的低价氧化物与Y单质分子的电子总数相等,则X为C元素,Y为N元素;Z、V、W的最高价氧化物的水化物两两相互反应,又最高价氧化物的水化物不是酸就是碱,则Z、V、W的最高价氧化物的水化物中必定有个显两性,故只有氢氧化铝显两性,又X、Y、Z、U、V、W、R是7种短周期主族元素,其原子序数依次增大,故Z为Na元素,V为Al元素,W为S元素;再根据X、Y、Z、U、V、W、R是7种短周期主族元素,其原子序数依次增大,则U为Mg元素,R为Cl元素据此解答.
(1)根据以上分析V原子的结构示意图即铝元素的原子结构示意图为 ,氮元素位于元素周期表中第二周期,第ⅤA族,最外层有5个电子,其气态氢化物原子间通过共用电子对形成共价键,所以其电子式为:
,氮元素位于元素周期表中第二周期,第ⅤA族,最外层有5个电子,其气态氢化物原子间通过共用电子对形成共价键,所以其电子式为: ,故答案为:
,故答案为: ;
; .
.
(2)N的最高价氧化物对应的水化物的稀溶液与Mg的单质反应时,即氮的最高价氧化物对应的水化物为硝酸,又N被还原到最低价,则反应方程式为:4Mg+10HNO3=4Mg(NO3)2+NH4NO3+3H2O,故答案:4Mg+10HNO3=4Mg(NO3)2+NH4NO3+3H2O
(3)标准状况下4.48L C的最高价氧化物通入200mL 2mol/L Na的碳酸正盐溶液中,反应为CO2+Na2CO3+H2O=2NaHCO3则根据方程式发现碳酸钠过量0.2mol,生成碳酸氢钠0.4mol,所得溶液中碳酸钠0.2mol和碳酸氢钠0.4mol,碳酸根离子和碳酸氢根离子水解而使溶液呈碱性,则c(OH-)>c(H+),碳酸钠0.2mol和碳酸氢钠0.4mol,所以c(HCO3-)>c(CO32-),钠离子不水解,离子浓度最大,所以离子浓度大小顺序是c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),
故答案为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);
(4)常温下R单质与Z的最高价氧化物对应水化物反应的离子方程式,即Cl2与NaOH的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O,故答案:Cl2+2OH-=Cl-+ClO-+H2O
(5)由方程式可知反应中Na被氧化,应为原电池负极反应,电极方程式为Na-e?=Na+,S化合价降低,被还原,为原电池正极反应,电极方程式为aS+2e?→Sa2?;钠高能电池中负极为钠,有23g钠消耗释放1mol e-,则207g钠消耗时转移
mol=9mol e-,铅蓄电池的电极反应为:Pb+PbO2+2H2SO4═2PbSO4+2H2O,铅蓄电池中铅是负极,207g铅消耗时转移 2mol e-,故钠硫电池的理论放电量是铅蓄电池的:9÷2=4.5 倍;
故答案:aS+2e?→Sa2-;4.5 倍
(1)根据以上分析V原子的结构示意图即铝元素的原子结构示意图为
 ,氮元素位于元素周期表中第二周期,第ⅤA族,最外层有5个电子,其气态氢化物原子间通过共用电子对形成共价键,所以其电子式为:
,氮元素位于元素周期表中第二周期,第ⅤA族,最外层有5个电子,其气态氢化物原子间通过共用电子对形成共价键,所以其电子式为: ,故答案为:
,故答案为: ;
; .
.(2)N的最高价氧化物对应的水化物的稀溶液与Mg的单质反应时,即氮的最高价氧化物对应的水化物为硝酸,又N被还原到最低价,则反应方程式为:4Mg+10HNO3=4Mg(NO3)2+NH4NO3+3H2O,故答案:4Mg+10HNO3=4Mg(NO3)2+NH4NO3+3H2O
(3)标准状况下4.48L C的最高价氧化物通入200mL 2mol/L Na的碳酸正盐溶液中,反应为CO2+Na2CO3+H2O=2NaHCO3则根据方程式发现碳酸钠过量0.2mol,生成碳酸氢钠0.4mol,所得溶液中碳酸钠0.2mol和碳酸氢钠0.4mol,碳酸根离子和碳酸氢根离子水解而使溶液呈碱性,则c(OH-)>c(H+),碳酸钠0.2mol和碳酸氢钠0.4mol,所以c(HCO3-)>c(CO32-),钠离子不水解,离子浓度最大,所以离子浓度大小顺序是c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),
故答案为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);
(4)常温下R单质与Z的最高价氧化物对应水化物反应的离子方程式,即Cl2与NaOH的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O,故答案:Cl2+2OH-=Cl-+ClO-+H2O
(5)由方程式可知反应中Na被氧化,应为原电池负极反应,电极方程式为Na-e?=Na+,S化合价降低,被还原,为原电池正极反应,电极方程式为aS+2e?→Sa2?;钠高能电池中负极为钠,有23g钠消耗释放1mol e-,则207g钠消耗时转移
| 207 |
| 23 |
故答案:aS+2e?→Sa2-;4.5 倍
点评:本题以无机推断为载体考查了化学用语、方程式、离子浓度的比较以及原电池原理等知识点,明确原电池正负极上得失电子及反应类型是解本题关键,难点是电极反应式的书写,正确推断物质是解本题关键,难点是离子浓度大小的比较,难度中等.

练习册系列答案
 全程金卷系列答案
全程金卷系列答案 快乐5加2金卷系列答案
快乐5加2金卷系列答案
相关题目
下列说法合理的是( )
| A、若X+和Y2-的核外电子层结构相同,则原子序数:X>Y |
| B、由水溶液的酸性:HCI>H2S,可推断出元素的非金属性:CI>S |
| C、邻羟基苯甲醛沸点高于对羟基苯甲醛是因为形成了分子内氢键 |
| D、H-F、H-O、H-N三种共价键的极性逐渐增强 |
下列说法正确的是( )
| A、无水硫酸铜的吸水性较浓硫酸强 |
| B、将石灰石、纯碱、石英在玻璃熔炉中高温熔融可制得玻璃 |
| C、把铜片和铁片用导线连接后一起插入三氯化铁溶液中,在铜片表面出现一层铁 |
| D、取5mL 0.1 mol?L-1 FeCl3溶液,滴加0.1 mol?L-1 KI溶液5~6滴,再加入少量KSCN溶液,溶液呈红色,说明该反应有一定的限度 |
标准状体下,用质量相同的4种气体吹气球,那种气体吹起的气球体积最大( )
| A、O2 |
| B、H2 |
| C、CH4 |
| D、CO2 |
将下列各组物质按酸、碱、盐分类顺序排列,其中正确的是( )
| A、硫酸 纯碱 孔雀石[Cu2(OH)2CO3] |
| B、硝酸 烧碱 绿矾[FeSO4?7H2O] |
| C、醋酸 乙醇 碳酸钙 |
| D、盐酸 熟石灰 苛性钠 |
下列关于化学变化的说法中,错误的是( )
| A、化学键断裂时要吸收能量,形成新化学键时要放出能量 |
| B、化学变化的实质是旧化学键断裂,新化学键形成 |
| C、在化学变化过程中,一定要吸收或放出能量 |
| D、吸收能量或放出能量的过程,一定是化学变化过程 |
铜有两种常见的氧化物CuO和Cu2O.某学习小组取0.98g(用精密天平测量)Cu(OH)2固体加热,有铜的氧化物生成,其质量随温度变化如图1所示:另外,某同学绘制了三条表示金属氧化物与其所含金属元素的质量的关系曲线,如图2所示.则下列分析正确的是( )
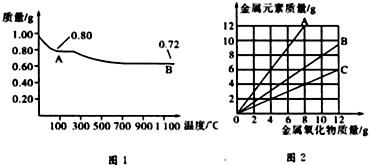

| A、图1中,A到B的过程中有0.01 mol电子发生了转移 |
| B、图1整个过程中共生成0.26 g水 |
| C、图2三条曲线中,表示CuO和其中所含Cu元素质量关系的曲线是A |
| D、图1中A和B化学式分别为Cu2O和CuO |