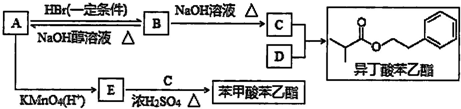
题目内容
铜粉放入稀硫酸中,加热后无现象,当加入一种盐后,铜粉的质量减少,溶液变蓝,同时有气体产生,此盐应是( )
| A、氯化钾 | B、硫酸钾 |
| C、硝酸钾 | D、硫酸铵 |
考点:铜金属及其重要化合物的主要性质,浓硫酸的性质
专题:元素及其化合物
分析:根据铜的化学性质:铜不能与非氧化性酸(硫酸、盐酸)反应,但可以和氧化性酸(硝酸)反应,据此解答即可.
解答:
解:铜不与硫酸反应,但是可以与稀HNO3反应,由该反应的离子方程式:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,可知Cu遇到H+、NO3-能发生氧化还原反应,本题中有氢离子,故加入硝酸钾,即加入了硝酸根,能反应,溶液变蓝,且有NO气体放出,
故选C.
故选C.
点评:本题主要考查了金属铜的化学性质,对于铜和硝酸的反应要特别注意,可以直接加硝酸也可以分步产生:先加非氧化性酸(如盐酸、稀硫酸)后加硝酸盐.

练习册系列答案
相关题目
下列说法正确的是( )
| A、无水硫酸铜的吸水性较浓硫酸强 |
| B、将石灰石、纯碱、石英在玻璃熔炉中高温熔融可制得玻璃 |
| C、把铜片和铁片用导线连接后一起插入三氯化铁溶液中,在铜片表面出现一层铁 |
| D、取5mL 0.1 mol?L-1 FeCl3溶液,滴加0.1 mol?L-1 KI溶液5~6滴,再加入少量KSCN溶液,溶液呈红色,说明该反应有一定的限度 |
已知下列热化学方程式:
Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H=-24.8kJ?mol-1
Fe2O3(s)+
CO(g)═
Fe3O4(s)+
CO2(g)△H=-15.73kJ?mol-1
Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)△H=+640.4kJ?mol-1
则14g CO气体还原足量FeO固体得到Fe固体和CO2气体时对应的△H约为( )
Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H=-24.8kJ?mol-1
Fe2O3(s)+
| 1 |
| 3 |
| 2 |
| 3 |
| 1 |
| 3 |
Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)△H=+640.4kJ?mol-1
则14g CO气体还原足量FeO固体得到Fe固体和CO2气体时对应的△H约为( )
| A、-218kJ?mol-1 |
| B、-109kJ?mol-1 |
| C、+218kJ?mol-1 |
| D、+109kJ?mol-1 |
在密闭容器中,将1.0mol CO与1.0mol H2O混合加热到800℃,发生下列反应:CO(g)+H2O(g)?CO2(g)+H2(g).一段时间后该反应达到平衡,测得CO的物质的量为0.5mol.则下列说法正确的是( )
| A、800℃下,该反应的化学平衡常数为0.25 |
| B、427℃时该反应的平衡常数为9.4,则该反应的△H<0 |
| C、800℃下,若继续向该平衡体系中通入1.0mol的CO(g),则平衡时CO物质的量分数为33.3% |
| D、800℃下,若继续向该平衡体系中通入1.0mol的H2O(g),则平衡时CO转化率为33.3% |
铜有两种常见的氧化物CuO和Cu2O.某学习小组取0.98g(用精密天平测量)Cu(OH)2固体加热,有铜的氧化物生成,其质量随温度变化如图1所示:另外,某同学绘制了三条表示金属氧化物与其所含金属元素的质量的关系曲线,如图2所示.则下列分析正确的是( )
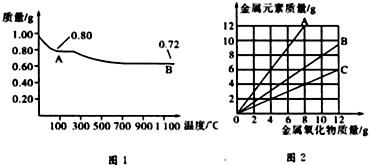

| A、图1中,A到B的过程中有0.01 mol电子发生了转移 |
| B、图1整个过程中共生成0.26 g水 |
| C、图2三条曲线中,表示CuO和其中所含Cu元素质量关系的曲线是A |
| D、图1中A和B化学式分别为Cu2O和CuO |
 请用如图的装置设计一个实验,以测定SO2转化为SO3的转化率.
请用如图的装置设计一个实验,以测定SO2转化为SO3的转化率.