题目内容
13.I 铜是人类最早使用的金属,它与人类生产生活关系密切,请运用所学知识解释下列与铜有关的化学现象.
(1)如图甲,在硫酸型酸雨地区,不纯的铜制品发生电化学腐蚀,Cu发生氧化反应(填写“氧化”或“还原”),写出正极的电极反应式O2+4H++4e-=2H2O;
(2)如图乙,将螺旋状的铜丝在酒精灯上灼烧,铜丝变黑色,然后将红热的铜丝插入NH4Cl固体中,过一会取出,发现插入部分的黑色变为光亮的红色,查阅资料可知,该过程有N2生成,写出由黑色变为光亮红色过程的反应方程式2NH4Cl+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2↑+2HCl+3H2O;
II 在一个密闭容器中发生反应:mA(g)+nB(g)?pC(g)
(1)该反应未加催化剂的v-t图象如图丙,若其他条件不变,仅在反应前加入合适的催化剂,则其v-t图象如图丁所示.以下说法正确的是②③⑤ (填序号)
①a1>a2
②b1<b2
③t1>t2
④右图中阴影部分面积更大
⑤两图中阴影部分面积相等
(2)在一定温度和不同压强下达到平衡时,分别得到物质A的物质的量浓度如下表
| 压强p/Pa | 2×105 | 5×105 | 1×106 |
| c(A)/mol•L-1 | 0.08 | 0.20 | 0.44 |
②当压强从2×105加压到5×105时,平衡的移动方向是C.
A.朝正反应方向移动 B.朝逆反应方向移动 C.不移动 D.不能确定
③其他条件相同时,在上述三个压强下分别发生该反应.2×105 Pa时,A的转化率随时间变化如图2,请在图中补充画出压强分别为5×105 Pa 和1×106 Pa时,A的转化率随时间的变化曲线(请在图线上标出压强).
分析 I(1)活泼的铜是负极发生氧化反应,发生吸氧化腐蚀,正极反应式为:O2+4H++4e-=2H2O;
(2)氯化铵受热分解,生成的氨气还原氧化铜,生成铜和氮气,所以反应方程式为:2NH4Cl+3 CuO $\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2↑+2HCl+3H2O;
II(1)由图象可知,加入催化剂,反应速率增大,但催化剂只影响反应速率,不影响平衡移动,以此解答该题;
(2)①当压强为2×105 Pa时,此反应的平衡常数表达式为平衡时生成物浓度幂之积比上反应物浓度幂之积;
②根据压强变化与浓度变化关系分析;
③2×105与5×105 Pa时A的转化率不变,反应时间缩短,1×106 Pa时,A的转化率减小,反应速率增大时间缩短.
解答 解:I(1)活泼的铜是负极发生氧化反应,发生吸氧化腐蚀,正极反应式为:O2+4H++4e-=2H2O,故答案为:氧化,O2+4H++4e-=2H2O;
(2)氯化铵受热分解,生成的氨气还原氧化铜,生成铜和氮气,所以反应方程式为:2NH4Cl+3 CuO $\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2↑+2HCl+3H2O,故答案为:2NH4Cl+3 CuO $\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2↑+2HCl+3H2O;
II(1)加入催化剂的结果一是正、逆反应速率都增大,二是缩短了达到平衡的时间.由此可得:a1<a2、b1<b2、t1>t2,但不使平衡移动推知,阴影面积为反应物浓度的变化,由于催化剂不影响平衡移动,则两图中阴影部分面积相等.
故答案为:②③⑤;
(2)①当压强为2×105 Pa时,此反应的平衡常数表达式为平衡时生成物浓度幂之积比上反应物浓度幂之积,所以K=$\frac{{c}^{p}(C)}{{c}^{m}(A){c}^{n}(B)}$,故答案为:$\frac{{c}^{p}(C)}{{c}^{m}(A){c}^{n}(B)}$;
②由表格数据可知当压强从2×105Pa增大为5×105Pa时,压强增大2.5倍,体积变为$\frac{1}{2.5}$倍,浓度由0.08增大为0.20mol•L-1,也增大2.5倍,所以增大压强平衡不移动,故选:C;
③2×105与5×105 Pa时A的转化率不变,反应时间缩短,1×106 Pa时,平衡逆移,A的转化率减小,反应速率增大,时间缩短,依此作图为: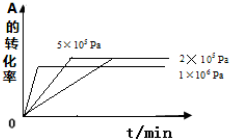 ,
,
故答案为: .
.
点评 本题考查了平衡常数、平衡移动、平衡图象等,综合性较强,难度中等,注意对图象和表格数据的分析是解题的关键,考查了学生分析图象提取图象信息的能力.

 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案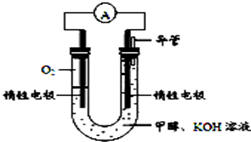 “低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视.所以“低碳经济”正成为科学家研究的主要课题
“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视.所以“低碳经济”正成为科学家研究的主要课题(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:5C+4KMnO4+6H2SO4=5CO2↑+4MnSO4+2K2SO4+6H2O
(2)将不同量的CO(g)和H2O(g)分别通入到体积为 2L的恒容密闭容器中,进行反应CO(g)+H2O(g)?CO2(g)+H2(g),得到如下二组数据:
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
②实验2条件下平衡常数K=0.17,该反应为放(填“吸”或“放”)热反应.
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
②2CO(g)+O2(g)═2CO2(g)△H=-566.0 kJ/mol
③H2O(g)=H2O(l))△H=-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ/mol
(4)某实验小组依据甲醇燃烧的反应原理,设计如右图所示的电池装置.
①该电池正极的电极反应为O2+H2O+4e-=4OH-.
②该电池工作时,溶液中的OH-向负极移动.
| A. | 原子半径依次增大 | B. | 单质的熔沸点逐渐升高 | ||
| C. | 卤离子的还原性逐渐减弱 | D. | 氢化物的热稳定性依次减弱 |
| A. | 2NO+O2═2NO2 | B. | 3NO2+H2O═2HNO3+NO | ||
| C. | 3H2+N2$?_{催化剂}^{高温高压}$3NH3 | D. | NH3+HNO3═NH4NO3 |

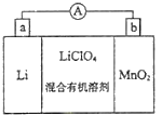 如图是锂锰电池的反应原理示意图,其中电解质KClO4溶于混合有机溶剂中,Li+ 通过电解质迁移入MnO2晶格中,得到LiMnO2.回答下列问题:
如图是锂锰电池的反应原理示意图,其中电解质KClO4溶于混合有机溶剂中,Li+ 通过电解质迁移入MnO2晶格中,得到LiMnO2.回答下列问题: