题目内容
8.Na2SO3•7H2O是食品工业中常用的漂白剂、抗氧化剂和防腐剂.Na2SO3在30℃时的溶解度为35.5g/100gH2O.(1)计算30℃时Na2SO3饱和溶液中Na2SO3的质量分数ω.(保留2位小数)26.20%
(2)将30℃的Na2SO3饱和溶液271g冷却到10℃,析出Na2SO3•7H2O晶体79.5g.计算10℃时Na2SO3在水中的溶解度.19.50g/100g水.
分析 (1)根据溶质的质量分数ω=$\frac{{m}_{溶质}}{{m}_{溶液}}$×100%计算;
(2)根据Na2SO3•7H2O晶体和原溶液中溶质的质量求出10℃是饱和溶液中溶质的质量和溶剂的质量,再求出10℃时Na2SO3在水中的溶解度,即100g水中溶解 Na2SO3的质量.
解答 解:(1)30℃时Na2SO3饱和溶液中Na2SO3的质量分数ω=$\frac{{m}_{溶质}}{{m}_{溶液}}$×100%=$\frac{35.5g}{35.5g+100g}$×100%=26.20%,
答:30℃时Na2SO3饱和溶液中Na2SO3的质量分数为26.20%.
(2)冷却溶液后,析出晶体79.5g,根据其晶体Na2SO3•7H2O的组成,其中含有水和亚硫酸钠为:
m(Na2SO3)=79.5g×$\frac{126}{126+126}$=39.75g,
m(H2O)=79.5g-39.75g=39.75g,
10℃时Na2SO3的质量为271-200-39.75=31.25g,
10℃时H2O的质量为200-39.75=160.25g,
假设10℃时Na2SO3的溶解度为S,则
$\frac{S}{100g}=\frac{31.25g}{160.25g}$,
解得S=19.5g;
答:10℃时Na2SO3在水中的溶解度为19.50g/100g水.
点评 本题考查了溶液的质量分数的和溶解度的数理关系,难度中等,侧重于基本概念以及数理分析能力和计算能力的培养.

练习册系列答案
相关题目
19.某原电池的结构如图所示,下列有关该原电池的说法不正确的是( )


| A. | 该电池工作时电能转变为化学能 | B. | 铁片的质量变轻 | ||
| C. | 铜片上发生的反应2H++2e-=H2↑ | D. | SO42-向铁片移动 |
16.下列叙述中,正确的是( )
| A. | 水泥、玻璃、水晶饰物都是硅酸盐制品 | |
| B. | 用澄清石灰水鉴别SO2 和CO2 | |
| C. | 将Fe(NO3)2 溶于稀盐酸,滴加KSCN 溶液没有颜色变化 | |
| D. | 透闪石的化学成分为Ca2Mg5Si8O22(OH)2 写成氧化物的形式为:2CaO•5MgO•8SiO2•H2O |
3.关于某温度时的饱和溶液的说法中,正确的是( )
| A. | 已溶解的溶质和未溶解的溶质质量相等 | |
| B. | 溶质不再溶解,因此从表面看溶质不再减少,也不再增加 | |
| C. | 升高温度,饱和溶液将变为不饱和溶液 | |
| D. | 溶质的溶解和结晶继续进行,且速率相等 |
13.I 铜是人类最早使用的金属,它与人类生产生活关系密切,请运用所学知识解释下列与铜有关的化学现象.

(1)如图甲,在硫酸型酸雨地区,不纯的铜制品发生电化学腐蚀,Cu发生氧化反应(填写“氧化”或“还原”),写出正极的电极反应式O2+4H++4e-=2H2O;
(2)如图乙,将螺旋状的铜丝在酒精灯上灼烧,铜丝变黑色,然后将红热的铜丝插入NH4Cl固体中,过一会取出,发现插入部分的黑色变为光亮的红色,查阅资料可知,该过程有N2生成,写出由黑色变为光亮红色过程的反应方程式2NH4Cl+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2↑+2HCl+3H2O;
II 在一个密闭容器中发生反应:mA(g)+nB(g)?pC(g)
(1)该反应未加催化剂的v-t图象如图丙,若其他条件不变,仅在反应前加入合适的催化剂,则其v-t图象如图丁所示.以下说法正确的是②③⑤ (填序号)
①a1>a2
②b1<b2
③t1>t2
④右图中阴影部分面积更大
⑤两图中阴影部分面积相等
(2)在一定温度和不同压强下达到平衡时,分别得到物质A的物质的量浓度如下表
①当压强为2×105 Pa时,此反应的平衡常数表达式:$\frac{{c}^{p}(C)}{{c}^{m}(A){c}^{n}(B)}$.
②当压强从2×105加压到5×105时,平衡的移动方向是C.
A.朝正反应方向移动 B.朝逆反应方向移动 C.不移动 D.不能确定
③其他条件相同时,在上述三个压强下分别发生该反应.2×105 Pa时,A的转化率随时间变化如图2,请在图中补充画出压强分别为5×105 Pa 和1×106 Pa时,A的转化率随时间的变化曲线(请在图线上标出压强).

(1)如图甲,在硫酸型酸雨地区,不纯的铜制品发生电化学腐蚀,Cu发生氧化反应(填写“氧化”或“还原”),写出正极的电极反应式O2+4H++4e-=2H2O;
(2)如图乙,将螺旋状的铜丝在酒精灯上灼烧,铜丝变黑色,然后将红热的铜丝插入NH4Cl固体中,过一会取出,发现插入部分的黑色变为光亮的红色,查阅资料可知,该过程有N2生成,写出由黑色变为光亮红色过程的反应方程式2NH4Cl+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2↑+2HCl+3H2O;
II 在一个密闭容器中发生反应:mA(g)+nB(g)?pC(g)
(1)该反应未加催化剂的v-t图象如图丙,若其他条件不变,仅在反应前加入合适的催化剂,则其v-t图象如图丁所示.以下说法正确的是②③⑤ (填序号)
①a1>a2
②b1<b2
③t1>t2
④右图中阴影部分面积更大
⑤两图中阴影部分面积相等
(2)在一定温度和不同压强下达到平衡时,分别得到物质A的物质的量浓度如下表
| 压强p/Pa | 2×105 | 5×105 | 1×106 |
| c(A)/mol•L-1 | 0.08 | 0.20 | 0.44 |
②当压强从2×105加压到5×105时,平衡的移动方向是C.
A.朝正反应方向移动 B.朝逆反应方向移动 C.不移动 D.不能确定
③其他条件相同时,在上述三个压强下分别发生该反应.2×105 Pa时,A的转化率随时间变化如图2,请在图中补充画出压强分别为5×105 Pa 和1×106 Pa时,A的转化率随时间的变化曲线(请在图线上标出压强).
20.下列四组实验,根据实验事实得出的结论,正确的是( )
| A. | 在五水硫酸铜中滴加少量浓硫酸,固体颜色由蓝变白,说明浓硫酸具有吸水性 | |
| B. | 在未知试液中滴加BaCl2溶液得白色沉淀,取该白色沉淀加稀盐酸不溶解,说明原未知试液中含有SO42- | |
| C. | 在铜片上滴加少量稀硫酸,无明显现象,说明稀硫酸没有氧化性 | |
| D. | 某未知气体通入品红溶液中,品红溶液褪色,则原气体一定是 SO2 |
17.几种短周期元素的原子半径及其某些化合价见下表:
分析上表中有关数据,并结合已学过的知识,回答以下问题.涉及上述元素的答案,请用元素符号表示.
(1)E元素在周期表中位于第三周期VIA族.
(2)A、H、J对应离子的半径由大到小的顺序是(填离子符号)F->Na+>Al3+,A离子的结构示意图为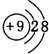 .
.
(3)上述元素的最高价氧化物对应水化物的酸性最强的为S,碱性最强的为Na(填元素符号);这两种元素形成化合物的电子式为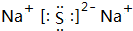 .
.
| 元素代号 | A | B | D | E | G | H | I | J |
| 化合价 | -1 | -2 | +4、-4 | +4、-2 | +5、-3 | +3 | +2 | +1 |
| 原子半径/nm | 0.071 | 0.074 | 0.077 | 0.102 | 0.110 | 0.143 | 0.160 | 0.186 |
(1)E元素在周期表中位于第三周期VIA族.
(2)A、H、J对应离子的半径由大到小的顺序是(填离子符号)F->Na+>Al3+,A离子的结构示意图为
 .
.(3)上述元素的最高价氧化物对应水化物的酸性最强的为S,碱性最强的为Na(填元素符号);这两种元素形成化合物的电子式为
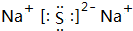 .
. 