题目内容
4.卤族元素随着原子核电荷数的增加,下列叙述不正确的是( )| A. | 原子半径依次增大 | B. | 单质的熔沸点逐渐升高 | ||
| C. | 卤离子的还原性逐渐减弱 | D. | 氢化物的热稳定性依次减弱 |
分析 A、卤族元素原子半径随着核电荷数的增大而增大;
B、单质的状态由气态变为液态再变为固体;
C、元素的非金属性越强,则对应阴离子的还原性越弱;
D、同一主族元素中,元素的非金属性随着核电荷数的增大而减弱,元素的非金属性越强,其氢化物越稳定.
解答 解:卤族元素的非金属性随着核电荷数的增大而减弱,
A、卤族元素的电子层数随着核电荷数的增大而增大,原子核对最外层电子的吸引力逐渐减弱,导致其原子半径随着核电荷数的增大而增大,故A正确;
B、单质的状态由气态变为液态再变为固体,故单质的熔沸点逐渐升高,故B正确;
C、元素的非金属性越强,则对应阴离子的还原性越弱,故卤素离子的还原性随着核电荷数的增加而逐渐变强,故C错误;
D、元素的非金属性越强,其氢化物越稳定,卤族元素的非金属性随着核电荷数的增大而减弱,所以其氢化物的稳定性依次减弱,故D正确;
故选C.
点评 本题考查了元素周期律,明确同一主族元素周期律的内涵是解本题关键,知道非金属元素非金属性强弱的判断方法,根据元素的非金属性强弱结合元素周期律来分析解答,题目难度不大.

练习册系列答案
相关题目
14.下列有关实验可行的是( )
①可用倒扣在NaOH溶液上面的漏斗装置吸收残余的Cl2
②混入KI溶液中的KHCO3可滴加盐酸除去
③碘升华形成的污迹可用热的浓盐酸洗去
④制Cl2后的黑褐色污迹可用热的浓盐酸洗去.
①可用倒扣在NaOH溶液上面的漏斗装置吸收残余的Cl2
②混入KI溶液中的KHCO3可滴加盐酸除去
③碘升华形成的污迹可用热的浓盐酸洗去
④制Cl2后的黑褐色污迹可用热的浓盐酸洗去.
| A. | ①② | B. | ②③ | C. | ③④ | D. | ①④ |
12.使用下列装置能达到实验目的是( )
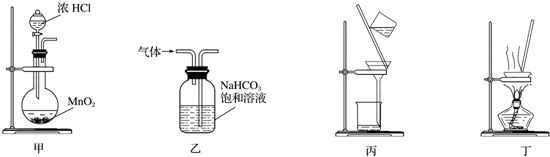

| A. | 用甲装置制取氯气 | B. | 用乙装置除去Cl2中的少量氯化氢 | ||
| C. | 粗盐的提纯过程中用到丙装置 | D. | 用丁装置蒸干溶液制取NH4HCO3 |
19.某原电池的结构如图所示,下列有关该原电池的说法不正确的是( )


| A. | 该电池工作时电能转变为化学能 | B. | 铁片的质量变轻 | ||
| C. | 铜片上发生的反应2H++2e-=H2↑ | D. | SO42-向铁片移动 |
9.铁的某种氧化物的组成可表示为FemOn,FemOn与足量稀硝酸反应时,参加反应的硝酸中,被还原的硝酸与没有被还原的硝酸物质的量之比为1:18,则m、n的值分别为( )
| A. | 4、5 | B. | 5、4 | C. | 3、4 | D. | 5、7 |
16.下列叙述中,正确的是( )
| A. | 水泥、玻璃、水晶饰物都是硅酸盐制品 | |
| B. | 用澄清石灰水鉴别SO2 和CO2 | |
| C. | 将Fe(NO3)2 溶于稀盐酸,滴加KSCN 溶液没有颜色变化 | |
| D. | 透闪石的化学成分为Ca2Mg5Si8O22(OH)2 写成氧化物的形式为:2CaO•5MgO•8SiO2•H2O |
13.I 铜是人类最早使用的金属,它与人类生产生活关系密切,请运用所学知识解释下列与铜有关的化学现象.

(1)如图甲,在硫酸型酸雨地区,不纯的铜制品发生电化学腐蚀,Cu发生氧化反应(填写“氧化”或“还原”),写出正极的电极反应式O2+4H++4e-=2H2O;
(2)如图乙,将螺旋状的铜丝在酒精灯上灼烧,铜丝变黑色,然后将红热的铜丝插入NH4Cl固体中,过一会取出,发现插入部分的黑色变为光亮的红色,查阅资料可知,该过程有N2生成,写出由黑色变为光亮红色过程的反应方程式2NH4Cl+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2↑+2HCl+3H2O;
II 在一个密闭容器中发生反应:mA(g)+nB(g)?pC(g)
(1)该反应未加催化剂的v-t图象如图丙,若其他条件不变,仅在反应前加入合适的催化剂,则其v-t图象如图丁所示.以下说法正确的是②③⑤ (填序号)
①a1>a2
②b1<b2
③t1>t2
④右图中阴影部分面积更大
⑤两图中阴影部分面积相等
(2)在一定温度和不同压强下达到平衡时,分别得到物质A的物质的量浓度如下表
①当压强为2×105 Pa时,此反应的平衡常数表达式:$\frac{{c}^{p}(C)}{{c}^{m}(A){c}^{n}(B)}$.
②当压强从2×105加压到5×105时,平衡的移动方向是C.
A.朝正反应方向移动 B.朝逆反应方向移动 C.不移动 D.不能确定
③其他条件相同时,在上述三个压强下分别发生该反应.2×105 Pa时,A的转化率随时间变化如图2,请在图中补充画出压强分别为5×105 Pa 和1×106 Pa时,A的转化率随时间的变化曲线(请在图线上标出压强).

(1)如图甲,在硫酸型酸雨地区,不纯的铜制品发生电化学腐蚀,Cu发生氧化反应(填写“氧化”或“还原”),写出正极的电极反应式O2+4H++4e-=2H2O;
(2)如图乙,将螺旋状的铜丝在酒精灯上灼烧,铜丝变黑色,然后将红热的铜丝插入NH4Cl固体中,过一会取出,发现插入部分的黑色变为光亮的红色,查阅资料可知,该过程有N2生成,写出由黑色变为光亮红色过程的反应方程式2NH4Cl+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2↑+2HCl+3H2O;
II 在一个密闭容器中发生反应:mA(g)+nB(g)?pC(g)
(1)该反应未加催化剂的v-t图象如图丙,若其他条件不变,仅在反应前加入合适的催化剂,则其v-t图象如图丁所示.以下说法正确的是②③⑤ (填序号)
①a1>a2
②b1<b2
③t1>t2
④右图中阴影部分面积更大
⑤两图中阴影部分面积相等
(2)在一定温度和不同压强下达到平衡时,分别得到物质A的物质的量浓度如下表
| 压强p/Pa | 2×105 | 5×105 | 1×106 |
| c(A)/mol•L-1 | 0.08 | 0.20 | 0.44 |
②当压强从2×105加压到5×105时,平衡的移动方向是C.
A.朝正反应方向移动 B.朝逆反应方向移动 C.不移动 D.不能确定
③其他条件相同时,在上述三个压强下分别发生该反应.2×105 Pa时,A的转化率随时间变化如图2,请在图中补充画出压强分别为5×105 Pa 和1×106 Pa时,A的转化率随时间的变化曲线(请在图线上标出压强).
14.分子式为C5H8的有机物,不可能是( )
| A. | 只含有1个双键的直链有机物 | B. | 含有2个双键的直链有机物 | ||
| C. | 含有1个双键的环状有机物 | D. | 含有1个叁键的直链有机物 |
 硫及其化合物广泛存在于自然界中,回答下列问题:
硫及其化合物广泛存在于自然界中,回答下列问题: