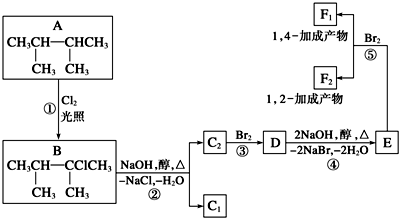
题目内容
侯氏制碱法制备的工业产物主要是( )
| A、碳酸钠 | B、氢氧化钠 |
| C、碳酸氢钠 | D、氯化铵 |
考点:纯碱工业(侯氏制碱法)
专题:元素及其化合物,化学应用
分析:“侯氏制碱法”的基本原理是:在浓氨水中通入足量的二氧化碳生成一种盐,然后在此盐溶液中加入细的食盐粉末.原始原料有浓氨水、二氧化碳、氯化钠,先制得NaHCO3,进而生产出纯碱,副产品氯化铵,据此分析解答.
解答:
解:A.我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献.他以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产出纯碱,有关反应的化学方程式为:NH3+CO2+H2O=NH4HCO3;NH4HCO3+NaCl=NaHCO3↓+NH4Cl;2NaHCO3
Na2CO3+CO2↑+H2O,所以工业产物主要是Na2CO3,故A正确;
B.“侯氏制碱法”无论反应物、生成物、中间产物,均与氢氧化钠无关,故B错误;
C.由A可知:NaHCO3为中间产物,故C错误;
D.氯化铵为副产品,故D错误;
故选A.
| ||
B.“侯氏制碱法”无论反应物、生成物、中间产物,均与氢氧化钠无关,故B错误;
C.由A可知:NaHCO3为中间产物,故C错误;
D.氯化铵为副产品,故D错误;
故选A.
点评:本题考查“侯氏制碱法”,理解其基本原理与流程、反应物、产物的性质等是正确解答本题的关键,题目难度不大.

练习册系列答案
 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案
相关题目
若NA表示阿伏伽德罗常数,下列说法正确的是( )
| A、在同温同压时,相同体积的任何气体所含的原子数目相同 |
| B、将49gH2SO4溶于1L水中,所得溶液的物质的量浓度为0.5mol?L-1 |
| C、标准状况下,11.2L水所含的分子数为0.5NA |
| D、18g NH4+含有的电子数为10NA |
下列检验方法和结论都正确的是( )
| A、加入AgNO3溶液有白色沉淀生成,证明原溶液中一定有大量Cl- |
| B、加入硝酸后的溶液中,滴加BaCl2溶液,有白色沉淀生成,证明原溶液中一定有大量SO42- |
| C、加入盐酸后,放出能使澄清石灰水变浑浊的无色气体,证明原溶液中一定含有大量CO32- |
| D、加入无色酚酞试液后,溶液显红色,证明原溶液中一定含有大量OH- |
对实验Ⅰ~Ⅳ的实验现象预测正确的是( )
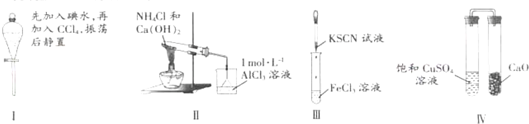

| A、实验Ⅰ:液体分层,下层呈无色 |
| B、实验Ⅱ:烧杯中先出现白色沉淀,后溶解 |
| C、实验Ⅲ:试管中溶液颜色仍无色 |
| D、实验Ⅳ:放置一段时间后,饱和CuSO4溶液中出现蓝色晶体 |
常温下,下列各组物质不能用一种试剂通过化学反应区别的是( )
| A、C CuO FeO |
| B、(NH4)2SO4 K2SO4 NH4Cl |
| C、Na2CO3 NaHCO3 K2CO3 |
| D、AgNO3 KNO3 Na2CO3 |