题目内容
18.央视《每周质量报告》曝光了河北省一些明胶企业将皮革废料熬制成工业明胶,出售给浙江绍兴某些制药企业,最终变成药用胶囊进入患者腹中.明胶是水溶性蛋白质混合物,溶于水形成胶体.由工业明胶制成的胶囊往往含有超标的重金属Cr,从而对人体造成伤害.①已知Fe(CrO2)2中铬元素是+3价,则其中铁元素是+2价.
②CrO2-是一种酸根离子,则Fe(CrO2)2属于盐(填“酸”、“碱”、“盐”或“氧化物”).
③明胶的水溶液和K2SO4溶液共同具备的性质是C.
A.都不稳定,密封放置会产生沉淀
B.两者均有丁达尔现象
C.分散质粒子都可通过滤纸.
分析 ①根据化合物中化合价的代数和为零计算;
②盐是指一类金属离子或铵根离子(NH4+)与酸根离子或非金属离子结合的化合物;
③A.胶体较稳定,溶液稳定;
B.溶液无丁达尔效应;
C.胶粒和溶液都可透过滤纸.
解答 解:①Fe(CrO2)2中,氧元素的化合价是-2价,总的负价是-8价,铬元素的化合价是+3价,2个铬原子化合价是+6价,所以铁元素化合价是+2价;故答案为:+2;
②Fe(CrO2)2是由亚铁离子和CrO2-组成的盐,故答案为:盐;
③A.胶体较稳定,溶液是稳定的,故错误;
B.溶液无丁达尔效应,胶体有丁达尔效应,故错误;
C.胶粒和溶液都可透过滤纸,所以明胶的水溶液和K2SO4溶液中的分散质粒子可通过滤纸,故正确;
故答案为:C.
点评 本题考查较综合,涉及化合价判断、胶体的性质等,注重高频考点的考查,把握物质的性质为解答的关键,题目难度不大.

练习册系列答案
相关题目
2.对下列实验过程的评价,正确的是( )
| A. | 某固体中加入稀盐酸,产生了无色气体,证明该固体一定会有CO32- | |
| B. | 某溶液中滴加了Na2CO3溶液,生成白色沉淀,该溶液中一定会有Ba2+ | |
| C. | 某无色溶液滴加酚酞试液显红色,该溶液不一定是碱液 | |
| D. | 验证烧碱溶液中是否含Cl-,先加稀HCl除去OH-,再加AgNO3溶液,有白色沉淀出现,证明含Cl- |
9.1918年,德国化学家弗里茨•哈伯因为发明合成氨方法而获得诺贝尔化学奖.1931年,卡尔•博施因为改进合成氨方法获得诺贝尔化学奖.2007年10月诺贝尔化学奖授予了德国化学家格哈德•埃特尔,理由是他发现了哈伯一博施法合成氨的作用机理.现向一密闭容器中充入1 mol N2和3 mol H2,在一定条件下使该反应发生,下列有关说法正确的是( )
| A. | 达到化学平衡时,将完全转化为NH3 | |
| B. | 达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等 | |
| C. | 达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化 | |
| D. | 达到化学平衡时,正反应速率和逆反应速率都为零 |
3.已知热化学方程式2SO2(g)+O2(g)?2SO3(g)+Q kJ(Q>0),下列说法中正确的是( )
| A. | 2 mol SO2(g)和1mol O2(g)具有的能量之和低于2 mol SO3(g)具有的能量 | |
| B. | 将2 mol SO2(g)和1mol O2(g)置于一密闭容器中充分反应后放出Q kJ的热量 | |
| C. | 升高温度,平衡向逆反应方向移动,上述热化学方程式中的Q值减小 | |
| D. | 将一定量SO2(g)和O2(g)置于某密闭容器中充分反应后放热Q kJ,则此过程中有2 mol SO2被氧化 |
7.浓硝酸不具有的性质是( )
| A. | 不稳定性 | B. | 可溶解水晶 | C. | 强氧化性 | D. | 易挥发性 |
8.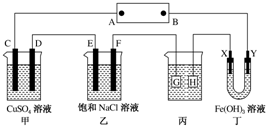 如图所示的装置,C、D、E、F、X、Y都是惰性电极.将电池接通后,向乙中滴入酚酞溶液,在F极附近溶液显红色.则以下说法正确的是( )
如图所示的装置,C、D、E、F、X、Y都是惰性电极.将电池接通后,向乙中滴入酚酞溶液,在F极附近溶液显红色.则以下说法正确的是( )
 如图所示的装置,C、D、E、F、X、Y都是惰性电极.将电池接通后,向乙中滴入酚酞溶液,在F极附近溶液显红色.则以下说法正确的是( )
如图所示的装置,C、D、E、F、X、Y都是惰性电极.将电池接通后,向乙中滴入酚酞溶液,在F极附近溶液显红色.则以下说法正确的是( )| A. | 电源B极是正极 | |
| B. | 甲、乙装置的C、D、E、F电极均有单质生成,其物质的量之比为1:2:2:1 | |
| C. | 欲用丙装置给铜镀银,H应该是Ag,电镀液是AgNO3溶液 | |
| D. | 装置丁中Y极附近红褐色变深,说明氢氧化铁胶粒带正电荷 |