题目内容
7.下列叙述不正确的是( )| A. | 0.1 mol/L的Na2S溶液中:c(OH-)=c(H+)+c(HS-)+2c(H2S) | |
| B. | 0.1 mol/L的Na2CO3溶液中:c(Na+ )+2[c(CO3 2-)+c(HCO3-)+c(H2CO3)] | |
| C. | 浓度均为0.1mol•L-1 的碳酸钠溶液和氨水溶液中,由水电离的出的 c(OH-):前者大于后者 | |
| D. | 浓度为0.1 mol/L NH4Cl和0.1mol/L NH3•H2O等体积混合溶液中pH>7,则:c(NH4+ )>c(Cl-)>c(OH-)>c(NH3•H2O)>c(H+) |
分析 A.0.1 mol/L的Na2S溶液中存在质子守恒,溶液中水电离出的所有氢离子浓度和氢氧根离子浓度相同;
B.0.1 mol/L的Na2CO3溶液中存在物料守恒n(Na)=2n(C),钠离子浓度等于所有碳元素存在形式总和;
C.水解的盐促进水的电离,酸碱抑制水的电离;
D.浓度为0.1 mol/L NH4Cl和0.1mol/L NH3•H2O等体积混合溶液中pH>7,溶液显碱性,说明一水合氨电离程度大于铵根离子水解程度;
解答 解:A.0.1 mol/L的Na2S溶液中存在质子守恒,溶液中水电离出的所有氢离子浓度和氢氧根离子浓度相同,c(OH-)=c(H+)+c(HS-)+2c(H2S),故A正确;
B.0.1 mol/L的Na2CO3溶液中存在物料守恒n(Na)=2n(C),c(Na+ )=2[c(CO3 2-)+c(HCO3-)+c(H2CO3)],故B正确;
C.水解的盐促进水的电离,酸碱抑制水的电离,浓度均为0.1mol•L-1 的碳酸钠溶液和氨水溶液中,由水电离的出的 c(OH-):前者大于后者,故C正确;
D.浓度为0.1 mol/L NH4Cl和0.1mol/L NH3•H2O等体积混合溶液中pH>7,溶液显碱性,说明一水合氨电离程度大于铵根离子水解程度,溶液中浓度大小为:c(NH4+ )>c(Cl-)>c(NH3•H2O)>c(OH-)>c(H+),故D错误;
故选D.
点评 本题考查了电解质溶液中质子守恒、物料守恒、离子浓度大小比较、注意盐类水解和弱电解质电离平衡的影响因素分析判断,掌握基础是解题关键,题目难度中等.

练习册系列答案
相关题目
15.将固体NH4I置于密闭容器中,在某温度下发生下列反应:NH4I(s)?NH3(g)+HI(g);2HI(g)?H2(g)+I2(g),当反应达到平衡时,C(H2)=0.5mol/L,C(HI)=4mol/L,则第一个反应在该温度下的平衡常数是( )
| A. | 20 | B. | 15 | C. | 25 | D. | 16 |
2.若用过量的纯锌粒与一定量的稀硫酸反应,为了加快反应速率又不影响产生氢气的量,下列措施可行的是( )(填序号).
| A. | 微热 | B. | 加入适量氧化铜 | ||
| C. | 加入少量硫酸铜溶液 | D. | 加水 | ||
| E. | 加入少量氢氧化钡溶液 |
12.常温下把铁片投入下列溶液中,铁片被溶解,溶液的质量增加但没有气体产生的是( )
| A. | 硫酸铁溶液 | B. | 浓硝酸 | C. | 盐酸 | D. | 硫酸铜溶液 |
2.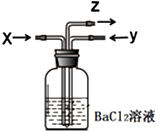 碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图),下列说法正确的是( )
碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图),下列说法正确的是( )
 碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图),下列说法正确的是( )
碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图),下列说法正确的是( )| A. | 洗气瓶中产生的沉淀是BaCO3 | B. | Z导管出来的气体中无CO2 | ||
| C. | 洗气瓶中产生的沉淀只有BaSO4 | D. | 洗气瓶中产生的沉淀可能有BaSO3 |
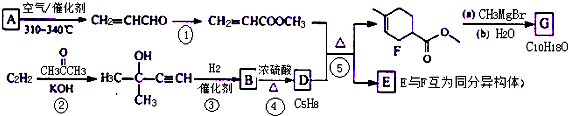
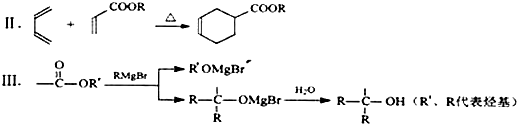
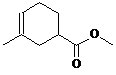 、
、
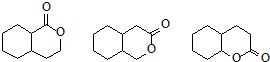 (其中任意一种).
(其中任意一种).
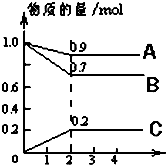 某温度时,在2L密闭容器中,A、B、C三种物质的物质的量随时间的变化曲线如图所示.由图中数据分析:
某温度时,在2L密闭容器中,A、B、C三种物质的物质的量随时间的变化曲线如图所示.由图中数据分析: