题目内容
2.若用过量的纯锌粒与一定量的稀硫酸反应,为了加快反应速率又不影响产生氢气的量,下列措施可行的是( )(填序号).| A. | 微热 | B. | 加入适量氧化铜 | ||
| C. | 加入少量硫酸铜溶液 | D. | 加水 | ||
| E. | 加入少量氢氧化钡溶液 |
分析 常见影响反应速率的因素有浓度、温度、压强、催化剂以及固体表面积等,影响硫酸和锌反应的速率的因素有浓度、温度和固体的表面积大小,加快反应速率,应使浓度增大、温度升高或增大固体表面积,不影响生成氢气的总量,则硫酸的物质的量应不变,以此解答.
解答 解:A.升高温度,活化分子百分数增加,反应速率增大,且氢气的总量不变,故A正确;
B.加入式量氧化铜,消耗硫酸,生成氢气的量减少,故B错误;
C.加入少量硫酸铜溶液,锌置换出铜,可形成原电池反应,反应速率增大,且氢气的总量不变,故C正确;
D.加入水,浓度减小,反应速率减小,故D错误;
E.加入少量氢氧化钡溶液,消耗硫酸,生成氢气的总量减少,故E错误.
故选AC.
点评 本题考查化学反应速率的影响因素,为高频考点,侧重于学生的分析能力和基础知识的综合理解和运用的考查,注意相关基础知识的积累,难度不大.

练习册系列答案
 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案
相关题目
12.一定温度下,水存在电离平衡H2O(l)?H+(aq)+OH-(aq),下列叙述一定正确的是( )
| A. | 向水中加入KHSO4溶液,平衡逆向移动,Kw减小 | |
| B. | 将水加热,Kw增大,pH减小,但还是中性 | |
| C. | 向水中加入少量CH3COONa固体,平衡逆向移动,c(H+)降低 | |
| D. | 向水中加入AlCl3溶液,平衡向右移动,KW增大 |
13.乙醇分子结构中,各化学键如图所示.关于乙醇在各种反应中断键的说法不正确的是( )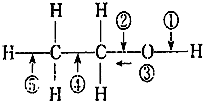

| A. | 和金属钠反应时断裂① | |
| B. | 乙醇燃烧时断裂②和⑤ | |
| C. | 在银催化条件下,与O2反应时断裂①和③ | |
| D. | 和浓H2SO4、乙酸共热时断裂①,其他键不变化 |
17.2011年11月1日凌晨,“神舟八号”飞船成功发射升空,之后完成了与此前发射的“天宫一号”的成功交会对接,其中新材料铝锂合金为“太空之吻”提供了保障.下列对铝元素和锂元素的认识正确的是( )
| A. | 锂是碱金属元素,可以保存在煤油中 | |
| B. | 铝离子和锂离子的核外电子排布相同 | |
| C. | Li+的半径大于H-的半径 | |
| D. | 短周期中能与强碱反应产生H2的金属元素是铝,在周期表中位于第ⅢA族 |
7.下列叙述不正确的是( )
| A. | 0.1 mol/L的Na2S溶液中:c(OH-)=c(H+)+c(HS-)+2c(H2S) | |
| B. | 0.1 mol/L的Na2CO3溶液中:c(Na+ )+2[c(CO3 2-)+c(HCO3-)+c(H2CO3)] | |
| C. | 浓度均为0.1mol•L-1 的碳酸钠溶液和氨水溶液中,由水电离的出的 c(OH-):前者大于后者 | |
| D. | 浓度为0.1 mol/L NH4Cl和0.1mol/L NH3•H2O等体积混合溶液中pH>7,则:c(NH4+ )>c(Cl-)>c(OH-)>c(NH3•H2O)>c(H+) |
14.下列解释事实的方程式不正确的是( )
| A. | 测0.1mol•L-1氨水的pH为11:NH3•H2O?NH${\;}_{4}^{+}$+OH- | |
| B. | 将Na块放入水中,放出气体:2Na+2H2O=2NaOH+H2↑ | |
| C. | 铝片溶于NaOH溶液中,产生气体:2Al+2OH-+2H2O=2AlO${\;}_{2}^{-}$+3H2↑ | |
| D. | 用CuCl2溶液做导电实验,灯泡发光:CuCl2$\frac{\underline{\;电解\;}}{\;}$Cu2++2Cl- |
17.下面是利用盐桥电池从某些含碘盐中提取碘的两个装置,下列说法中正确的是( )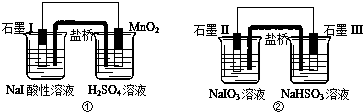

| A. | 两个装置中石墨I和石墨II作负极 | |
| B. | 碘元素在装置①中被氧化,在装置②中被还原 | |
| C. | ①中MnO2的电极反应式为:MnO2+2H2O+2e-═Mn2++4OH? | |
| D. | 反应①、②中生成等量的I2时导线上通过的电子数之比为1:5 |
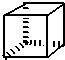 “立方烷”是新合成的一种烃,其分子为正立方体结构,其结构如图所示:
“立方烷”是新合成的一种烃,其分子为正立方体结构,其结构如图所示: ;这种芳香烃异构体与单体ACH2=C(CH3)CC(CH3)=CH2(写结构简式)可合成具有
;这种芳香烃异构体与单体ACH2=C(CH3)CC(CH3)=CH2(写结构简式)可合成具有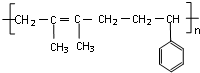
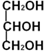 )与足量丙酸(CH3CH2COOH)发生酯化的反应方程式:
)与足量丙酸(CH3CH2COOH)发生酯化的反应方程式: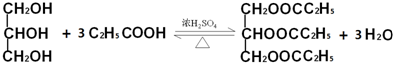
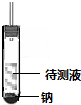 若有气泡产生(且产生的气体可燃)则其结构为CH3CH2OH;如无明显现象,则为CH3OCH3.
若有气泡产生(且产生的气体可燃)则其结构为CH3CH2OH;如无明显现象,则为CH3OCH3.