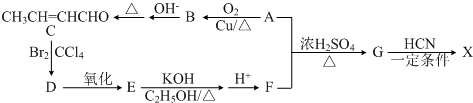
题目内容
下列正确的是( )
| A、将一定量氨气通入0.1 mol?L-1 NH4Cl溶液中可能有:c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
| B、AgCl沉淀易转化成AgI沉淀且Ksp(AgX)=c(Ag+)?c(X-),故Ksp(AgI)>K(AgCl) |
| C、F、Cl、Br、I的非金属性逐渐减弱,HF、HCl、HBr、HI水溶液的酸性逐渐减弱 |
| D、短周期元素形成离子后,最外层均达8电子稳定结构 |
考点:难溶电解质的溶解平衡及沉淀转化的本质,非金属在元素周期表中的位置及其性质递变的规律,离子键的形成
专题:元素周期律与元素周期表专题,电离平衡与溶液的pH专题
分析:A、选项中为可能,故满足电荷守恒即可;
B、根据沉淀转化原理:溶解度小的能转化为溶解度更小的解答;
C、非金属性越强,故得电子能力、最高价氧化物对应水化物的酸性越强;
D、氢离子没有电子,锂离子最外层为2个电子的稳定结构.
B、根据沉淀转化原理:溶解度小的能转化为溶解度更小的解答;
C、非金属性越强,故得电子能力、最高价氧化物对应水化物的酸性越强;
D、氢离子没有电子,锂离子最外层为2个电子的稳定结构.
解答:
解:A、将一定量氨气通入0.1 mol?L-1 NH4Cl溶液中可能有:c(NH4+)>c(Cl-)>c(OH-)>c(H+),因为只要满足c(NH4+)+c(H+)=c(OH-)+c(Cl-)即可,A正确;
B、根据沉淀转化原理:溶解度小的能转化为溶解度更小的,所以AgCl沉淀易转化成AgI沉淀且Ksp(AgX)=c(Ag+)?c(X-),故Ksp(AgI)<Ksp (AgCl),故B错误;
C、F、Cl、Br、I的非金属性逐渐减弱,HF、HCl、HBr、HI水溶液的酸性逐渐增强,故C错误;
D、氢离子没有电子,不满足8电子稳定结构,锂离子为2个电子的稳定结构,故D错误,故选A.
B、根据沉淀转化原理:溶解度小的能转化为溶解度更小的,所以AgCl沉淀易转化成AgI沉淀且Ksp(AgX)=c(Ag+)?c(X-),故Ksp(AgI)<Ksp (AgCl),故B错误;
C、F、Cl、Br、I的非金属性逐渐减弱,HF、HCl、HBr、HI水溶液的酸性逐渐增强,故C错误;
D、氢离子没有电子,不满足8电子稳定结构,锂离子为2个电子的稳定结构,故D错误,故选A.
点评:本题考查溶液电中性原则、沉淀溶解平衡、结构位置性质关系、核外电子排布规律、元素周期律等,难度不大.

练习册系列答案
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案
相关题目
下列关于盖斯定律描述不正确的是( )
| A、化学反应的反应热不仅与反应体系的始态和终态有关,也与反应的途径有关 |
| B、盖斯定律遵守能量守恒定律 |
| C、利用盖斯定律可间接计算通过实验难测定的反应的反应热 |
| D、利用盖斯定律可以计算有副反应发生的反应的反应热 |
常温,向一定体积V mL浓度均为 0.1mol?L-1 FeCl3和FeCl2溶液中滴加NaOH溶液至pH=4,溶液中有沉淀生成,过滤,得到沉淀和滤液.已知:Ksp[Fe(OH)3]=4.0×10-38,Ksp[Fe(OH)2]=8.0×10-16.下列说法正确的是( )
| A、滤液中c(Fe3+)=4.0×10-29mol?L-1 |
| B、沉淀为Fe(OH)3和Fe(OH)2的混合物 |
| C、向滤液中加入少量FeCl2溶液,一定有沉淀生成 |
| D、向滤液中继续加入NaOH溶液使pH>7时,有Fe(OH)2沉淀生成 |
 已知:pAg=-lg{c(Ag+)},Ksp(AgCl)=1×10-12.如图是向10mL AgNO3溶液中逐渐加入0.1mol?L-1的NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积(单位mL)变化的图象(实线).根据图象所得下列结论正确的是[提示:Ksp(AgCl)>Ksp(AgI)]( )
已知:pAg=-lg{c(Ag+)},Ksp(AgCl)=1×10-12.如图是向10mL AgNO3溶液中逐渐加入0.1mol?L-1的NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积(单位mL)变化的图象(实线).根据图象所得下列结论正确的是[提示:Ksp(AgCl)>Ksp(AgI)]( )| A、原AgNO3溶液的物质的量浓度为1mol?L-1 |
| B、图中x点的坐标为(100,6) |
| C、若升高温度,图象不会发生变化 |
| D、把0.1mol?L-1的NaCl换成0.1mol?L-1 NaI则图象在终点后变为虚线部分 |
向AgCl饱和溶液中滴加足量NaBr溶液,产生淡黄色沉淀,再向溶液中滴加KI溶液又产生黄色沉淀.有关下列说法正确的是( )
| A、产生的淡黄色沉淀为AgI |
| B、产生的黄色沉淀为AgBr |
| C、由上述实验现象可说明溶解度S(AgBr)>S(AgI)>S(AgCl) |
| D、上述实验理解说明沉淀可相互转化 |
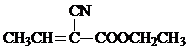 )是合成某种手术用粘合剂的单体,X的合成路线如下:
)是合成某种手术用粘合剂的单体,X的合成路线如下: