题目内容
化学无处不在,与化学有关的说法正确的是( )
| A、中性溶液的pH都相等 |
| B、新型净水材料高铁酸钠是生产自来水理想的净水剂和杀菌剂 |
| C、127I和131I2互为同位素 |
| D、△H<0,△S<0的化学反应不能自发进行 |
考点:同位素及其应用,焓变和熵变,探究溶液的酸碱性
专题:
分析:A.水的电离和温度有关,中性溶液pH大小和温度有关;
B.高铁酸钠中铁为最高价,具有强氧化性,铁离子水解生成胶体,具有吸附性;
C.同位素是同种元素的不同原子之间的互称;
D.反应自发进行的判断依据是△H-T△S<0,反应自发进行,△H-T△S>0,反应非自发进行.
B.高铁酸钠中铁为最高价,具有强氧化性,铁离子水解生成胶体,具有吸附性;
C.同位素是同种元素的不同原子之间的互称;
D.反应自发进行的判断依据是△H-T△S<0,反应自发进行,△H-T△S>0,反应非自发进行.
解答:
解:A.水的电离和温度有关,温度升高,水的电离程度增大,中性溶液pH减小,故A错误;
B.高铁酸钠中铁为最高价,具有强氧化性,能杀灭细菌,另一个原因可能是高铁酸钠的还原产物Fe3+能水解生成Fe(OH)3胶体,能吸附水中悬浮物,从而净水,故B正确;
C.同位素是同种元素的不同原子之间的互称,127I为原子,131I2为单质,故C错误;
D.若△H<0,△S<0,依据△H-T△S分析判断,低温时可自发进行,故D错误;
故选B.
B.高铁酸钠中铁为最高价,具有强氧化性,能杀灭细菌,另一个原因可能是高铁酸钠的还原产物Fe3+能水解生成Fe(OH)3胶体,能吸附水中悬浮物,从而净水,故B正确;
C.同位素是同种元素的不同原子之间的互称,127I为原子,131I2为单质,故C错误;
D.若△H<0,△S<0,依据△H-T△S分析判断,低温时可自发进行,故D错误;
故选B.
点评:本题考查了水的电离、氧化还原反应的应用、同位素、反应进行的方向等,较简单.注意水的电离和温度有关.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
青少年及成人缺乏某种微量元素将导致甲状腺肿大,而且会造成智力损坏,该微量元素是( )
| A、碘 | B、铁 | C、钙 | D、碳 |
下列反应的离子方程式不正确的是( )
| A、碳酸钙和稀盐酸反应:CaCO3+2H+═Ca2++CO2↑+H2O |
| B、硫酸铵溶液与氢氧化钡溶液反应:Ba2++SO42-═BaSO4↓ |
| C、CO2通入过量氢氧化钠溶液中 CO2+2OH-═CO32-+H2O |
| D、CuO与盐酸反应:CuO+2H+═Cu2++H2O |
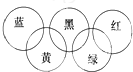 奥运会会标是五环旗,假定奥运五环旗中的一环表示一种物质,相连环物质间一定条件下能发生常见反应,不相连环物质间不能发生反应,且四种反应中必须包含化合反应、置换反应及复分解反应,适合的一组是( )
奥运会会标是五环旗,假定奥运五环旗中的一环表示一种物质,相连环物质间一定条件下能发生常见反应,不相连环物质间不能发生反应,且四种反应中必须包含化合反应、置换反应及复分解反应,适合的一组是( )
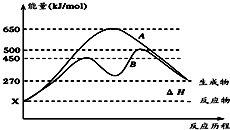 (1)已知:①Fe(s)+
(1)已知:①Fe(s)+
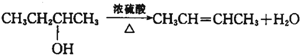
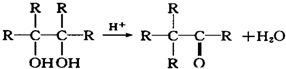

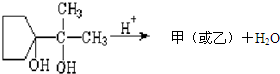
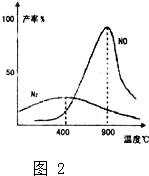
 (1)在1L密闭容器内,800℃时发生反应:2NO(g)+O2(g)?2N02(g)△H<0,容器内各物质的浓度变化如图1所示.
(1)在1L密闭容器内,800℃时发生反应:2NO(g)+O2(g)?2N02(g)△H<0,容器内各物质的浓度变化如图1所示.