题目内容
下列实验操作或做法正确的是( )
| A、用托盘天平称量5.85 g氯化钠固体 |
| B、从试剂瓶中取Na2CO3溶液,发现取量过多,为了不浪费,把过量的试剂倒入原试剂瓶中 |
| C、用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中 |
| D、用蒸发的方法使NaCl从溶液中析出时,应将蒸发皿中NaCl溶液全部加热蒸干 |
考点:化学实验方案的评价
专题:实验评价题
分析:A.托盘天平精确到0.1g;
B.一些易变质的药品在使用时一般不能放回原试剂瓶;
C.容量瓶只能在常温下使用,不能用来盛装过冷或过热的液体;
D.蒸发结晶法中,在蒸发水时,不可将液体蒸干.
B.一些易变质的药品在使用时一般不能放回原试剂瓶;
C.容量瓶只能在常温下使用,不能用来盛装过冷或过热的液体;
D.蒸发结晶法中,在蒸发水时,不可将液体蒸干.
解答:
解:A.托盘天平精确到0.1g,无法称量5.85 g氯化钠固体,故A错误;
B.Na2CO3易吸收空气中二氧化碳而变质,为防止试剂污染,不能放回原试剂瓶,故B错误;
C.容量瓶只能在常温下使用,不能用来盛装过冷或过热的液体,浓硫酸溶于水放热,溶液的温度较高,应冷却后在转移到容量瓶中,故C正确;
D.用蒸发方法来获得固体的方法:点燃酒精灯加热,并搅拌,当有较多晶体析出时,停止加热,借余热蒸干,故D错误.
故选C.
B.Na2CO3易吸收空气中二氧化碳而变质,为防止试剂污染,不能放回原试剂瓶,故B错误;
C.容量瓶只能在常温下使用,不能用来盛装过冷或过热的液体,浓硫酸溶于水放热,溶液的温度较高,应冷却后在转移到容量瓶中,故C正确;
D.用蒸发方法来获得固体的方法:点燃酒精灯加热,并搅拌,当有较多晶体析出时,停止加热,借余热蒸干,故D错误.
故选C.
点评:本题考查较为综合,涉及基础实验操作,侧重于学生的分析能力和实验能力的考查,为高频考点,注意把握实验的方法、步骤和使用的仪器,注重相关基础知识的积累,难度不大.

练习册系列答案
相关题目
下列关于实验原理或操作的叙述中,不正确的是( )
| A、判断皂化反应是否完全,可取反应后的混合液滴入热水中 |
| B、减压过滤不宜过滤胶状沉淀或颗粒太小的沉淀 |
| C、制备硫酸亚铁铵晶体,需加热至大量晶体析出并剩余少量液体即停止加热 |
| D、易燃试剂与强氧化性试剂需分开放置,并远离火源;金属着火时可用细沙覆盖灭火 |
下列分子或离子在指定的分散系中能大量共存的一组是( )
| A、碱性溶液中:ClO-、Cl-、K+、Na+ |
| B、常温常压下气体:O2、N2、Cl2、NH3 |
| C、含有AlO2-的溶液:NO3-、HCO3-、Na+、K+ |
| D、氢氧化铁胶体:H+、K+、S2-、Br- |
某无色透明溶液中,下列离子能够大量共存的是( )
| A、H+、NH4+、AlO2-、S2O32- |
| B、K+、Cu2+、OH-、Cr2O72- |
| C、Na+、Al3+、SO42-、NO3- |
| D、Ag+、Mg2+、CO32-、I- |
已知下面三个数据:7.2×10-4、4.6×10-4、4.9×10-10分别是下列有关的三种酸的电离常数,若已知下列反应可以发生:NaCN+HNO2═HCN+NaNO2 NaCN+HF═HCN+NaF NaNO2+HF═HNO2+NaF.由此可判断下列叙述中不正确的是( )
| A、K(HF)=7.2×10-4 |
| B、K(HNO2)=4.9×10-10 |
| C、根据两个反应即可得出一元弱酸的强弱顺序为HF>HNO2>HCN |
| D、K(HCN)<K(HNO2)<K(HF) |
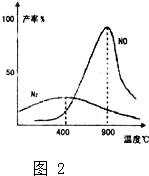
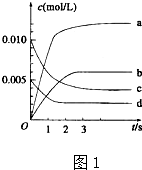 (1)在1L密闭容器内,800℃时发生反应:2NO(g)+O2(g)?2N02(g)△H<0,容器内各物质的浓度变化如图1所示.
(1)在1L密闭容器内,800℃时发生反应:2NO(g)+O2(g)?2N02(g)△H<0,容器内各物质的浓度变化如图1所示.