题目内容
下列溶液中有关微粒的物质的量浓度关系正确的是( )
| A、等体积等物质的量浓度的NaClO(aq)与NaCl(aq)中离子总数:N前>N后 |
| B、NaHSO3和NaHCO3的中性混合溶液中(S和C均用R表示):c(Na+)>c(HRO3-)+c(RO32-) |
| C、常温下将醋酸钠、盐酸两溶液混合后溶液呈中性,则混合溶液中:c(Na+)>c(Cl-)>c(CH3COOH) |
| D、常温下,将0.1mol?L-1NH4Cl溶液与0.05mol?L-1NaOH溶液等体积混合:c(C1-)>c(Na+)>c(NH4+)>c(OH-)>c(H+) |
考点:离子浓度大小的比较
专题:
分析:A.等体积等物质的量浓度的NaClO(aq)与NaCl(aq)中离子总数,需要分析离子水解的过程中离子变化和特征分析;
B.根据混合液中的电荷守恒、溶液显示中性进行解答;
C.根据电荷守恒c(Na+)+c(H+)=c(OH-)+c(Cl-)+c(CH3COO-)、物料守恒c(Na+)=c(CH3COOH)+c(CH3COO-)及溶液为中性进行判断;
D.反应后的溶液中溶质为等浓度的一水合氨、氯化钠、氯化铵,由于一水合氨的电离程度大于铵根离子的水解,则c(Na+)<c(NH4+).
B.根据混合液中的电荷守恒、溶液显示中性进行解答;
C.根据电荷守恒c(Na+)+c(H+)=c(OH-)+c(Cl-)+c(CH3COO-)、物料守恒c(Na+)=c(CH3COOH)+c(CH3COO-)及溶液为中性进行判断;
D.反应后的溶液中溶质为等浓度的一水合氨、氯化钠、氯化铵,由于一水合氨的电离程度大于铵根离子的水解,则c(Na+)<c(NH4+).
解答:
解:A.等体积等物质的量浓度的NaClO(aq)与NaCl(aq)中离子总数,ClO-+H2O?HClO+OH-,水解前后离子数不变,所以N后═N前,故A错误;
B.根据电荷守恒可得:c(Na+)+c(H+)=c(HRO3-)+2c(RO32-)+c(OH-),由于溶液为中性,则c(H+)=c(OH-),c(Na+)=c(HRO3-)+2c(RO32-),所以c(Na+)>c(HRO3-)+c(RO32-),故B正确;
C.溶液中存在电荷守恒:c(Na+)+c(H+)=c(OH-)+c(Cl-)+c(CH3COO-),由于溶液显示中性,c(H+)=c(OH-),则①c(Na+)=c(Cl-)+c(CH3COO-),根据物料守恒可得:②c(Na+)=c(CH3COOH)+c(CH3COO-),根据①②可得c(Cl-)=c(CH3COOH),则溶液中离子浓度关系为:c(Na+)>c(Cl-)=c(CH3COOH),故C错误;
D.混合后溶液中的溶质为NH3?H2O、NH4Cl、NaCl,其浓度相同都是0.025mol?L-1,由于氨水的电离程度大于铵根离子的水解程度,所以溶液显碱性,混合溶液中离子浓度大小为:c(C1-)>c(NH4+)>c(Na+)>c(OH-)>c(H+),故D错误.
故选B.
B.根据电荷守恒可得:c(Na+)+c(H+)=c(HRO3-)+2c(RO32-)+c(OH-),由于溶液为中性,则c(H+)=c(OH-),c(Na+)=c(HRO3-)+2c(RO32-),所以c(Na+)>c(HRO3-)+c(RO32-),故B正确;
C.溶液中存在电荷守恒:c(Na+)+c(H+)=c(OH-)+c(Cl-)+c(CH3COO-),由于溶液显示中性,c(H+)=c(OH-),则①c(Na+)=c(Cl-)+c(CH3COO-),根据物料守恒可得:②c(Na+)=c(CH3COOH)+c(CH3COO-),根据①②可得c(Cl-)=c(CH3COOH),则溶液中离子浓度关系为:c(Na+)>c(Cl-)=c(CH3COOH),故C错误;
D.混合后溶液中的溶质为NH3?H2O、NH4Cl、NaCl,其浓度相同都是0.025mol?L-1,由于氨水的电离程度大于铵根离子的水解程度,所以溶液显碱性,混合溶液中离子浓度大小为:c(C1-)>c(NH4+)>c(Na+)>c(OH-)>c(H+),故D错误.
故选B.
点评:本题考查了溶液中离子浓度大小比较、盐类水解的应用,题目难度中等,完成该类题目,除了扎实掌握水溶液中离子平衡的基础知识外,还需掌握做题的技巧和方法,如电荷守恒式的灵活应用,该题综合性强,较为全面的考查了水溶液中的离子平衡知识.

练习册系列答案
相关题目
下列说法正确的是( )
| A、在由水电离产生的氢离子浓度为10-13 mol?L-1的溶液中,Ca2+、K+、Cl-、HCO3-四种离子能大量共存 |
| B、已知MgCO3的Ksp═6.82×10-6,则所有含有固体MgCO3的溶液中,都有c(Mg2+)=c(CO32-),且c(Mg2+)?c(CO32-)═6.82×10-6 |
| C、对于反应2N2H4(l)=N2(g)+2H2(g)△H=-50.6 kJ?mol-1,它只在高温下自发进行 |
| D、常温下,将0.2 mol?L-1某一元碱(ROH)溶液和0.1 mol?L-1HCl溶液等体积混合,混合后溶液pH<7,则c(ROH)>c(R+) |
下列溶液中微粒的物质的量浓度关系正确的是( )
| A、1L 0.1mol/L(NH4)2Fe(SO4)2的溶液:c(SO42-)>c(NH4+)>c(Fe2+)>c(OH-)>c(H+) |
| B、在Na2CO3和NaHCO3的混合溶液中:c(Na+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-) |
| C、常温下,CH3COONa溶液和盐酸混合所得中性溶液:c(Na+)>c(Cl-)=c(CH3COOH) |
| D、25℃时,pH=4.5的NaHC2O4溶液:c(HC2O4-)>c(C2O42-)>c(H2C2O4) |
下列各组中两个变化所发生的反应,属于同一类型的是( )
①由甲苯制甲基环己烷、由乙稀制溴乙烷
②乙烯使溴水褪色、乙炔使酸性高锰酸钾水溶液褪色
③由苯制硝基苯、由苯制苯磺酸.
①由甲苯制甲基环己烷、由乙稀制溴乙烷
②乙烯使溴水褪色、乙炔使酸性高锰酸钾水溶液褪色
③由苯制硝基苯、由苯制苯磺酸.
| A、只有②③ | B、只有①② |
| C、只有①③ | D、①②③ |
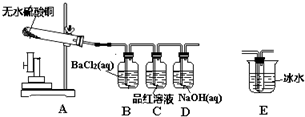
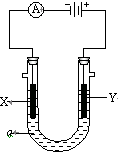 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题: