题目内容
下列说法正确的是( )
| A、在由水电离产生的氢离子浓度为10-13 mol?L-1的溶液中,Ca2+、K+、Cl-、HCO3-四种离子能大量共存 |
| B、已知MgCO3的Ksp═6.82×10-6,则所有含有固体MgCO3的溶液中,都有c(Mg2+)=c(CO32-),且c(Mg2+)?c(CO32-)═6.82×10-6 |
| C、对于反应2N2H4(l)=N2(g)+2H2(g)△H=-50.6 kJ?mol-1,它只在高温下自发进行 |
| D、常温下,将0.2 mol?L-1某一元碱(ROH)溶液和0.1 mol?L-1HCl溶液等体积混合,混合后溶液pH<7,则c(ROH)>c(R+) |
考点:酸碱混合时的定性判断及有关ph的计算,焓变和熵变,难溶电解质的溶解平衡及沉淀转化的本质,离子共存问题
专题:
分析:A.由水电离产生的氢离子浓度为10-13mol?L-1的溶液中存在大量氢离子或氢氧根离子,碱性溶液中,钙离子、碳酸氢根离子与氢氧根离子反应生成碳酸钙沉淀,书写溶液中,碳酸氢根离子与氢离子反应生成二氧化碳气体;
B.所有含有固体MgCO3的溶液中,c(Mg2+)、c(CO32-)的浓度不一定相等;
C.反应2N2H4(l)=N2(g)+2H2(g)△H=-50.6 kJ/mol,为熵增、焓减的反应,常温下也能进行;
D.将0.2 mol?L-1某一元碱ROH溶液和0.1 mol?L-1HCl溶液等体积混合,得到RCl和ROH的混合溶液,混合后溶液pH<7,则水解大于电离.
B.所有含有固体MgCO3的溶液中,c(Mg2+)、c(CO32-)的浓度不一定相等;
C.反应2N2H4(l)=N2(g)+2H2(g)△H=-50.6 kJ/mol,为熵增、焓减的反应,常温下也能进行;
D.将0.2 mol?L-1某一元碱ROH溶液和0.1 mol?L-1HCl溶液等体积混合,得到RCl和ROH的混合溶液,混合后溶液pH<7,则水解大于电离.
解答:
解:A.在由水电离产生的氢离子浓度为10-13mol?L-1的溶液为酸性或碱性溶液,溶液中存在大量H+或OH-,HCO3-离子既能够与酸反应也能够与碱反应,在溶液中一定不能大量共存,故A错误;
B.Ksp与温度有关,Ksp=c(Mg2+)?c(CO32-)=6.82×10-6成立,当含有镁离子或碳酸根离子的混合溶液中,碳酸根离子浓度和镁离子浓度不一定相同,故B错误;
C.反应2N2H4(l)=N2(g)+2H2(g)△H=-50.6 kJ/mol,为熵增、焓减的反应,由△G=△H-T△S可知常温下也能进行,故C错误;
D.将0.2 mol?L-1某一元碱ROH溶液和0.1 mol?L-1HCl溶液等体积混合,得到等量的RCl和ROH的混合溶液,混合后溶液pH<7,则R+的水解大于ROH的电离,所以c(ROH)>c(R+),故D正确.
故选D.
B.Ksp与温度有关,Ksp=c(Mg2+)?c(CO32-)=6.82×10-6成立,当含有镁离子或碳酸根离子的混合溶液中,碳酸根离子浓度和镁离子浓度不一定相同,故B错误;
C.反应2N2H4(l)=N2(g)+2H2(g)△H=-50.6 kJ/mol,为熵增、焓减的反应,由△G=△H-T△S可知常温下也能进行,故C错误;
D.将0.2 mol?L-1某一元碱ROH溶液和0.1 mol?L-1HCl溶液等体积混合,得到等量的RCl和ROH的混合溶液,混合后溶液pH<7,则R+的水解大于ROH的电离,所以c(ROH)>c(R+),故D正确.
故选D.
点评:本题考查酸碱混合的定性判断、离子的共存等知识,题目难度中等,明确习题中的信息是解答本题的关键,题目综合性较强,熟悉离子共存,酸碱反应后水解与电离、反应进行的方向、溶度积等知识即可解答,试题培养了学生的分析、理解能力及灵活应用所学知识的能力.

练习册系列答案
 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案
相关题目
下列有关物质的性质的说法正确的是( )
| A、金刚石、C60都有较大的硬度和较高的熔点 |
| B、在稀硫酸中加入铜粉,铜粉不溶解;再加入Cu(NO3)2固体,铜粉仍不溶解 |
| C、Cl2、SO2都可以使品红溶液褪色 |
| D、镁、铁等金属在一定条件下与水反应都生成对应的氢氧化物和氢气 |
已知甲为恒温、乙为恒压容器.两容器中均充入1molN2、3molH2,初始时两容器的温度、体积相同.一段时间后反应达到平衡,为使两容积中的N2在平衡混合物中的物质的量分数相同,下列措施中不可行的是( )
| A、向甲容器中充入一定量的氦气 |
| B、向乙容器中充入一定量的N2 |
| C、升高乙容器的温度 |
| D、增大甲容器的压强 |
下列溶液中有关微粒的物质的量浓度关系正确的是( )
| A、等体积等物质的量浓度的NaClO(aq)与NaCl(aq)中离子总数:N前>N后 |
| B、NaHSO3和NaHCO3的中性混合溶液中(S和C均用R表示):c(Na+)>c(HRO3-)+c(RO32-) |
| C、常温下将醋酸钠、盐酸两溶液混合后溶液呈中性,则混合溶液中:c(Na+)>c(Cl-)>c(CH3COOH) |
| D、常温下,将0.1mol?L-1NH4Cl溶液与0.05mol?L-1NaOH溶液等体积混合:c(C1-)>c(Na+)>c(NH4+)>c(OH-)>c(H+) |
 以CO2与H2为原料还可合成液体燃料甲醇(CH3OH),其反应的化学方程为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g);△H<0.现将1mol CO2和3mol H2充入容积为2L的密闭容器中发生上述反应,下列说法正确的是( )
以CO2与H2为原料还可合成液体燃料甲醇(CH3OH),其反应的化学方程为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g);△H<0.现将1mol CO2和3mol H2充入容积为2L的密闭容器中发生上述反应,下列说法正确的是( )| A、若保持恒温,当容器中n(CH3OH):n(H2O)为1:1时,该反应已达平衡状态 |
| B、若保持恒温,当容器内气体压强恒定时,该反应已达平衡状态 |
| C、若其他条件不变,实验结果如图所示,则平衡常数:K(T1)<K(T2) |
| D、保持温度不变,当反应已达平衡时,若向容器中再充入1 mol CO2和3 mol H2,当达到新平衡时,n(CH3OH):n(H2)将升高 |

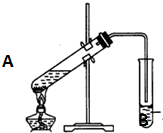 实验室用一定比例的乙醇、乙酸和浓硫酸的混合液制备乙酸乙酯,装置如图所示:
实验室用一定比例的乙醇、乙酸和浓硫酸的混合液制备乙酸乙酯,装置如图所示: