题目内容
15.下列说法中正确的是( )| A. | 一切物质中都存在化学键 | |
| B. | 含有共价键的物质是共价化合物 | |
| C. | 由非金属元素组成的化合物是共价化合物 | |
| D. | 两个非金属元素原子间不可能形成离子键 |
分析 A、稀有气体的分子中不存在化学键;
B、只含共价键的物质是共价化合物;
C.由非金属元素组成的化合物不一定是共价化合物,可能是离子化合物;
D.两个非金属元素原子间不易得失电子,易形成共用电子对.
解答 解:A、稀有气体的分子中不存在化学键,所以并不是所有物质中都存在化学键,故A错误;
B、只含共价键的物质是共价化合物,如氢氧化钠中含有共价键但是离子化合物,故B错误;
C.由非金属元素组成的化合物不一定是共价化合物,可能是离子化合物,如铵盐,故C错误;
D.两个非金属元素原子间不易得失电子,易形成共用电子对,即两个非金属元素原子间易形成共价键,不能形成离子键,故D正确;
故选D.
点评 本题考查了化学键与物质之间的关系,根据物质的构成微粒确定化学键,再结合物质结构分析解答,易错选项是AB,为易错点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
5.CuBr是一种白色晶体,见光或潮湿时受热易分解,在空气中逐渐变为浅绿色.实验室制备CuBr的反应原理为SO2+2CuSO4+2NaBr+2H2O═2CuBr↓+2H2SO4+Na2SO4,用下列装置进行实验,不能达到实验目的是( )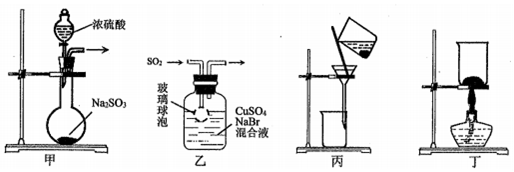

| A. | 用装置甲制取SO2 | B. | 用装置乙制取CuBr | ||
| C. | 用装置丙避光将CuBr与母液分离 | D. | 用装置丁干燥CuBr |
6.下列说法正确的是( )
| A. | 在合成塔中加入3molH2与1molN2反应即可得到2molNH3 | |
| B. | 工业上合成SO3时可加入过量空气以提高SO2的转化率 | |
| C. | 利用Al、Mg、NaOH溶液、导线及电流计等可证明Al的金属活动性大于Mg的 | |
| D. | 冰箱保存的食品不易变质,与化学反应速率无关 |
3.关于配合物[Cu(H2O)4]SO4,下列说法错误的是( )
| A. | 此配合物,中心离子的配位数为4 | |
| B. | H2O为配体,配位原子是氧原子 | |
| C. | 此配合物中,Cu2+提供孤对电子 | |
| D. | 向此配合物溶液中加入BaCl2溶液,出现白色沉淀 |
10.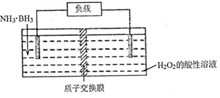 氨硼烷(NH3•BH3)电池可在常温下工作,装置如图所示.该电池工作时的总反应为:NH3•BH3+3H2O2=NH4BO2+4H2O.下列说法正确的是( )
氨硼烷(NH3•BH3)电池可在常温下工作,装置如图所示.该电池工作时的总反应为:NH3•BH3+3H2O2=NH4BO2+4H2O.下列说法正确的是( )
 氨硼烷(NH3•BH3)电池可在常温下工作,装置如图所示.该电池工作时的总反应为:NH3•BH3+3H2O2=NH4BO2+4H2O.下列说法正确的是( )
氨硼烷(NH3•BH3)电池可在常温下工作,装置如图所示.该电池工作时的总反应为:NH3•BH3+3H2O2=NH4BO2+4H2O.下列说法正确的是( )| A. | 负极附近溶液的PH增大 | |
| B. | 正极的反应式为:H2O2+2H++2e-=2H2O | |
| C. | 电池工作时,BO2-通过质子交换膜向正极移动 | |
| D. | 消耗3.lg氨硼烷,理论上转移0.2mol电子 |
20.下列关于化学反应限度的说法正确的是( )
| A. | 当一个可逆反应达到平衡状态时,就是这个反应在该条件下所能达到的限度 | |
| B. | 可以通过延长化学反应时间改变化学反应限度 | |
| C. | 平衡状态是一种静止的状态,因为反应物和生成物的浓度不再改变 | |
| D. | 化学反应的限度不可以通过改变条件而发生改变 |
7.莽草酸结构简式如图,有关说法正确的是( )
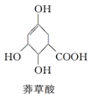

| A. | 分子中含有2种官能团 | |
| B. | 1mol莽草酸与Na反应最多生成4mol氢气 | |
| C. | 可与乙醇、乙酸反应,且反应类型相同 | |
| D. | 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同 |
4.下列叙述错误的是( )
| A. | 常温下,向0.1mol/LNH4HSO4溶液中滴加NaOH溶液至中性C(Na+)>c(SO42-)>c(NH4+)>c(OH-)=C(H+) | |
| B. | 向饱和NaClO溶液中滴加少量饱和FeSO4溶液,反应的离子方程式为2Fe2++ClO-+5H2O═2Fe(OH)3↓+Cl-+4H+ | |
| C. | 0.2mol•L-1CH3COOH溶液与0.1mol•L-1 NaOH溶液等体积混合2c(H+)-2c(OH-)=c(CH2COO-)-c(CH2COOH) | |
| D. | 常温下cmol/L、电离常数为Ka的酸HA溶液中,由水电离的浓度为c(H+)水=$\frac{1{0}^{-14}}{\sqrt{Ka•c}}$mol•L-1 |
20.第三周期,基态原子的第一电离能处于Al、P之间的元素有( )
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |