题目内容
7.莽草酸结构简式如图,有关说法正确的是( )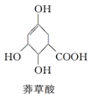
| A. | 分子中含有2种官能团 | |
| B. | 1mol莽草酸与Na反应最多生成4mol氢气 | |
| C. | 可与乙醇、乙酸反应,且反应类型相同 | |
| D. | 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同 |
分析 由结构可知,分子中含-COOH、-OH、碳碳双键,结合羧酸、醇、烯烃的性质来解答.
解答 解:A.含-COOH、-OH、碳碳双键三种官能团,故A错误;
B.能与钠反应的为羟基 和羧基,1mol莽草酸与Na反应最多生成2mol氢气,故B错误;
C.含有羧基、羟基,与乙醇、乙酸发生酯化反应,反应类型相同,故C正确;
D.含有碳碳双键,可与溴发生加成反应,与高锰酸钾发生氧化反应,故D错误.
故选C.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重羧酸、醇、烯烃的性质及分析与应用能力的考查,题目难度不大.

练习册系列答案
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案
相关题目
17.下列“化学知识原理”对“实际应用”的解释说明错误的是( )
| 选项 | 实际应用 | 化学知识原理 |
| A | 选用金属锂做锂电池的负极 | 锂轻且在空气中稳定 |
| B | 工业采用高压(20-50MPa)合成NH3 | 应用勒夏特列原理 |
| C | 施加石膏降低盐碱地(含Na2CO3)的碱性 | CaCO3溶度积小于CaSO4 |
| D | 在船身上装锌块来避免船体遭受腐蚀 | Zn比Fe活泼 |
| A. | A | B. | B | C. | C | D. | D |
18.下列图示与对应的叙述不相符合的是( )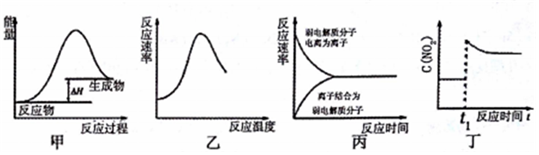

| A. | 图甲表示燃料燃烧反应的能量变化 | |
| B. | 图乙表示酶催化反应的反应速率随反应温度的变化 | |
| C. | 图丙表示弱电解质在水中建立电离平衡的过程 | |
| D. | 图丁表示平衡2NO2(g)?N2O4(g)在t1时迅速将体积缩小后c(NO2)的变化 |
15.下列说法中正确的是( )
| A. | 一切物质中都存在化学键 | |
| B. | 含有共价键的物质是共价化合物 | |
| C. | 由非金属元素组成的化合物是共价化合物 | |
| D. | 两个非金属元素原子间不可能形成离子键 |
19.为探究NO3-的性质,某实验小组学生进行下列系列实验探究,请按要求回答下列问题.
【查阅资料】活泼金属与1mol/L稀硝酸反应有H2和NH4+生成,NH4+生成的原理是产生H2的过程中NO3-被还原.
(l)实验I:生成NH4+电极反应式是NO3-+8e-+10 H+=NH4++3H2O;
(2)实验Ⅱ:电子流向:电子Mg电极经导线到Al极.
(3)实验Ⅲ:观察到的现象是电流计指针向右偏转,Mg电极上有无色气体产生,负极反应式为Al-3e-+4OH-=AlO2-+2H2O.
(4)实验IV:推测B中气体成分可能为NH3、H2.
【系列二】向盛有2mL 0.1mol/LBa(NO3)2溶液的试管中,缓慢通入SO2气体,试管内有白色沉淀产生,液面上方气体无色,接近瓶口处显浅棕色.
(5)学生甲推测是NO3-氧化SO2,他的推测证据是溶液中有沉淀产生、接近瓶口处显浅棕色.
(6)学生乙则推测是溶液中溶解的O2也氧化了SO2,且设计了如下实验证明了自己的推测正确:向2mL0.1mol/LBaCl2溶液中缓慢通入SO2,若观察到现象:试管内有白色沉淀产生,则乙推测成立.
(7)分别用0.1mol/LBa(NO3)2、O2氧化等量的SO2,消耗二者物质的量之比为2:1.
| 【系列一】实验 | 溶液X | 实验现象 | |
| 实验Ⅰ | 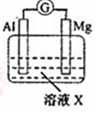 | 1mol/L稀硝酸 | 观察到电流计指针向左偏转. |
| 实验Ⅱ | 6mol/L稀硝酸 | 观察到电流计指针向左偏转,铝片表面产生无色气体,在液面上方变为红棕色 | |
| 实验Ⅲ | 6mol/LNaOH溶液 | 观察到(现象写在答题处). | |
| 实验Ⅳ | 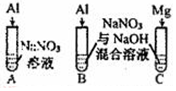 | A、C中均无明显现象,B中有无色气体生成. | |
(l)实验I:生成NH4+电极反应式是NO3-+8e-+10 H+=NH4++3H2O;
(2)实验Ⅱ:电子流向:电子Mg电极经导线到Al极.
(3)实验Ⅲ:观察到的现象是电流计指针向右偏转,Mg电极上有无色气体产生,负极反应式为Al-3e-+4OH-=AlO2-+2H2O.
(4)实验IV:推测B中气体成分可能为NH3、H2.
【系列二】向盛有2mL 0.1mol/LBa(NO3)2溶液的试管中,缓慢通入SO2气体,试管内有白色沉淀产生,液面上方气体无色,接近瓶口处显浅棕色.
(5)学生甲推测是NO3-氧化SO2,他的推测证据是溶液中有沉淀产生、接近瓶口处显浅棕色.
(6)学生乙则推测是溶液中溶解的O2也氧化了SO2,且设计了如下实验证明了自己的推测正确:向2mL0.1mol/LBaCl2溶液中缓慢通入SO2,若观察到现象:试管内有白色沉淀产生,则乙推测成立.
(7)分别用0.1mol/LBa(NO3)2、O2氧化等量的SO2,消耗二者物质的量之比为2:1.
11.一种以NaBH4和H2O2为原料的新型电池的工作原理如图所示.下列说法正确的是( )

| A. | 电子从电极a经电解质溶液流向电极b | |
| B. | 电池放电时Na+从b极区移向a极区 | |
| C. | 放电一段时间后,正极消耗的OH-和负极生成的OH-的量相等 | |
| D. | 电池的负极反应为BH4--8e-+8OH-=BO2+6H2O |
12.化学与生活密切相关,下列说法不正确的是( )
| A. | 用燃烧法可鉴别羊毛制品和涤纶制品 | |
| B. | 利用粮食酿酒经过了淀粉→葡萄糖→乙醇的化学变化过程 | |
| C. | 二氧化硫可广泛用于食品的增白 | |
| D. | 次氯酸钠溶液可用于环境的消毒杀菌 |
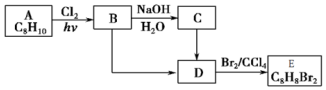
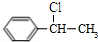 +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$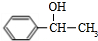 +NaCl;
+NaCl;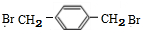 (写结构简式).
(写结构简式).