题目内容
20.下列关于化学反应限度的说法正确的是( )| A. | 当一个可逆反应达到平衡状态时,就是这个反应在该条件下所能达到的限度 | |
| B. | 可以通过延长化学反应时间改变化学反应限度 | |
| C. | 平衡状态是一种静止的状态,因为反应物和生成物的浓度不再改变 | |
| D. | 化学反应的限度不可以通过改变条件而发生改变 |
分析 当可逆反应达到平衡状态时,正逆反应速率相等,反应达到化学反应限度,此时各物质的浓度不再发生改变,但化学平衡为动态平衡,当外界条件发生变化时,平衡发生移动.
解答 解:A.当可逆反应达到平衡状态时,各物质的浓度不再发生改变,反应达到化学反应限度,故A正确;
B、化学反应的限度与反应时间无关,故B错误;
C、当化学反应在一定条件下达到限度时,正、逆反应速率相等,反应未停止,故C错误;
D、当化学反应在一定条件下达到限度时,正、逆反应速率相等,当外界条件改变导致正逆反应速率不等,限度发生改变,故D错误;
故选A.
点评 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.

练习册系列答案
相关题目
10.为了研究外界条件对H2O2分解速率的影响,有同学利用实验室提供的仪器和试剂设计了如下4组实验.注意:设计实验时,必须控制只有一个变量!
试剂:4% H2O2溶液,12% H2O2溶液,lmol/LFeCl3溶液
仪器:试管、带刻度的胶头滴管、酒精灯
(1)甲同学为了研究温度对化学反应速率的影响,应完成1、2实验(填组别).
(2)乙同学进行实验3与实验4,发现气体均缓慢产生,无法说明“浓度改变会影响化学反应速率”,你的改进方法是再同时分别向试管甲和试管乙中滴加2~3滴lmol/LFeCl3溶液作为催化剂.
(3)丙同学进行了实验1与实验4,你认为他想探究的是探究催化剂对化学反应速率的影响.该方案设计是否严谨?否(填是或否),说明理由试管中加入1mL1mol/LFeCl3溶液会使H2O2溶液的浓度降低.
试剂:4% H2O2溶液,12% H2O2溶液,lmol/LFeCl3溶液
仪器:试管、带刻度的胶头滴管、酒精灯
| 组别 | 实验温度 (℃) | H2O2溶液 | FeCl3溶液 (1mol/L) |
| 1 | 30 | 5mL 4% | 1mL |
| 2 | 60 | 5mL 4% | 1mL |
| 3 | 30 | 5mL 12% | |
| 4 | 30 | 5mL 4% |
(2)乙同学进行实验3与实验4,发现气体均缓慢产生,无法说明“浓度改变会影响化学反应速率”,你的改进方法是再同时分别向试管甲和试管乙中滴加2~3滴lmol/LFeCl3溶液作为催化剂.
(3)丙同学进行了实验1与实验4,你认为他想探究的是探究催化剂对化学反应速率的影响.该方案设计是否严谨?否(填是或否),说明理由试管中加入1mL1mol/LFeCl3溶液会使H2O2溶液的浓度降低.
15.下列说法中正确的是( )
| A. | 一切物质中都存在化学键 | |
| B. | 含有共价键的物质是共价化合物 | |
| C. | 由非金属元素组成的化合物是共价化合物 | |
| D. | 两个非金属元素原子间不可能形成离子键 |
5.催化加氢可生成3-甲基戊烷的是( )
| A. |  | B. |  | C. |  | D. |  |
4.己知室温时Ksp[Mg(OH)2]=1.8×l0-11,則此温度下Mg(OH)2在pH=12的NaOH溶液中的最大溶解浓度为( )
| A. | 1.8×l0-7mol/L | B. | 1.0×l0-5mol/L | C. | 1.0×l0-7mol/L | D. | 1.8×l0-9mol/L |
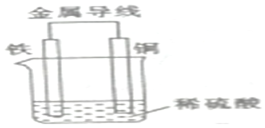 现有反应:①Ba(OH)2•8H2O+2NH4Cl═2NH3↑+BaCl2+10H2O,②Fe+H2SO4═FeSO4+H2↑.试回答下列问题:
现有反应:①Ba(OH)2•8H2O+2NH4Cl═2NH3↑+BaCl2+10H2O,②Fe+H2SO4═FeSO4+H2↑.试回答下列问题: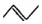
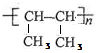 .
.
 .
.
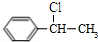 +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$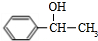 +NaCl;
+NaCl;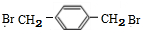 (写结构简式).
(写结构简式). )可用作临床麻醉剂,熔点约60℃.它的一条合成路线如下图所示(部分反应试剂和条件己省略):
)可用作临床麻醉剂,熔点约60℃.它的一条合成路线如下图所示(部分反应试剂和条件己省略):
 的结构不稳定.
的结构不稳定. .
.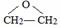 、FH3C-NH-CH3.
、FH3C-NH-CH3. 、
、 、
、 .
. ,若-X为烃基或羟基,再次取代时,新取代基在-X的邻位或对位;若-X为羧基或硝基,再次取代时,新取代基在-X的间位.参照上述合成路线,设计由甲苯合成
,若-X为烃基或羟基,再次取代时,新取代基在-X的邻位或对位;若-X为羧基或硝基,再次取代时,新取代基在-X的间位.参照上述合成路线,设计由甲苯合成 的合成路线(用合成路线流程图表示,并注明反应条件,合成过程中无机试剂可任选).
的合成路线(用合成路线流程图表示,并注明反应条件,合成过程中无机试剂可任选). .
.