题目内容
13.CaC2和ZnC2、Al4C3、Mg2C3、Li2C2等都同属于离子型碳化物.请通过对CaC2制C2H2的反应进行思考,从中得到必要的启示,判断下列反应产物 不正确的是( )| A. | ZnC2水解生成C2H2 | B. | A14C3水解生成C3H4 | ||
| C. | Mg2C3水解生成C3H4 | D. | Li2C2水解生成C2H2 |
分析 CaC2制C2H2的反应方程式为CaC2+2H2O=Ca(OH)2+C2H2↑,该反应中各元素化合价不变,相当于发生复分解反应,只要碳化物中碳元素反应前后各元素化合价不变即可,据此分析解答.
解答 解:A.ZnC2水解反应为:ZnC2+2H2O→Zn(OH)2+C2H2↑,生成C2H2,故A不选;
B.Al4C3水解反应为:Al4C3+12H2O→4Al(OH)3+3CH4↑,生成CH4,故B选;
C.Mg2C3水解反应为:Mg2C3+4H2O→C3H4↑+2Mg(OH)2,生成丙炔,故C不选;
D.Li2C2水解反应为:Li2C2+2H2O→2LiOH+C2H2↑,生成C2H2,故D不选;
故选B.
点评 本题以碳化钙和水反应制取乙炔为例考查碳化物水解反应产物,正确理解碳化钙和水反应中各元素化合价是否变化是解本题关键,注意有机物中碳元素采用平均化合价,题目难度不大.

练习册系列答案
相关题目
3.在10℃和2×105 Pa的条件下,反应aA(g)?dD(g)+eE(g)建立平衡后,再逐步增大体系的压强(温度不变).表列出了不同压强下平衡时物质D的浓度.
根据表中数据,回答下列问题:
(1)压强从2×105 Pa增加到5×105 Pa时,平衡移动方向是左,理由是D浓度增大的倍数小于压强增大的倍数.
(2)压强从5×105 Pa增加到1×106 Pa时,平衡移动方向是右,理由是D浓度增大的倍数大于压强增大的倍数,此时压强增大可能使E液化,使生成物的气体体积减小.
| 压强(Pa) | 2×105 | 5×105 | 1×106 |
| 浓度(mol•L-1) | 0.085 | 0.20 | 0.44 |
(1)压强从2×105 Pa增加到5×105 Pa时,平衡移动方向是左,理由是D浓度增大的倍数小于压强增大的倍数.
(2)压强从5×105 Pa增加到1×106 Pa时,平衡移动方向是右,理由是D浓度增大的倍数大于压强增大的倍数,此时压强增大可能使E液化,使生成物的气体体积减小.
4.下列有关物质的性质与用途具有对应关系的是( )
| A. | NH3极易溶于水,可用于工业制冷剂 | |
| B. | HNO3具有酸性,可用于制备硝酸盐原料 | |
| C. | NH4 NO3易溶于水,可用于制造高温材料 | |
| D. | N2难溶于水,可用于合成氨原料 |
1.下列化学式表示的物质一定是纯净物的是( )
| A. | C4H10 | B. | C | C. |  | D. | C2H6O |
8.下列化学用语不正确的是( )
| A. | 氯乙烯的结构简式:CH2CHCl | B. | 乙醇的分子式:C2H6O | ||
| C. | 苯的结构简式: | D. | 羟基的电子式: |
5.已知W、X、Y、Z为原子序数依次增大的短周期元素,W、Z同主族,X、Y、Z同周期,下列说法正确的是( )
| A. | W、X、Y、Z不可能全为非金属元素 | |
| B. | W的简单气态氢化物的沸点一定高于Z的简单气态氢化物的沸点 | |
| C. | 若W、X、Y的原子序数依次相差2,则在工业上制备Y的单质时,W、X、Y形成的化合物起到了重要作用 | |
| D. | 若W与X的原子序数相差4,则Z与X形成的化合物一定是离子化合物 |
2.下列电子式的书写正确的是( )
| A. | Mg2+ | B. | S2- | C. |  | D. |  |
3.X、Y、Z、M为原子序数依次增大的四种短周期元素.X、Y、Z同周期且相邻,M为唯一一种金属元素且最外层电子数为X、Y、Z最外层电子数之和的$\frac{1}{5}$.下列说法不正确的是( )
| A. | X、Y、Z形成的气态氢化物中稳定性最强的是H2Z | |
| B. | Y所在族的氢化物的沸点最高的是Y对应的氢化物 | |
| C. | 离子半径的大小:M>Y>Z | |
| D. | M的最高价氧化物对应的水化物可以溶解于Y对应最高价含氧酸 |
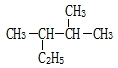 用系统命名法命名:2,3-二甲基丁烷
用系统命名法命名:2,3-二甲基丁烷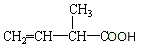 官能团的名称是碳碳双键、羧基
官能团的名称是碳碳双键、羧基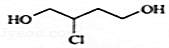 的分子式为C4H9O2Cl
的分子式为C4H9O2Cl