题目内容
3.在10℃和2×105 Pa的条件下,反应aA(g)?dD(g)+eE(g)建立平衡后,再逐步增大体系的压强(温度不变).表列出了不同压强下平衡时物质D的浓度.| 压强(Pa) | 2×105 | 5×105 | 1×106 |
| 浓度(mol•L-1) | 0.085 | 0.20 | 0.44 |
(1)压强从2×105 Pa增加到5×105 Pa时,平衡移动方向是左,理由是D浓度增大的倍数小于压强增大的倍数.
(2)压强从5×105 Pa增加到1×106 Pa时,平衡移动方向是右,理由是D浓度增大的倍数大于压强增大的倍数,此时压强增大可能使E液化,使生成物的气体体积减小.
分析 (1)压强从2×105Pa增加到5×105 Pa时,D的浓度应变化应该为0.2125mol/L,而图表中变化为0.20mol/L<0.2125mol/L,说明平衡逆向进行;
(2)5×106 Pa 增加到1×106 Pa时,D的浓度应变化为0.20mol/L的2倍即0.4mol/L,而图表中D的浓度为0.44mol/L,说明平衡正向进行.
解答 解:(1)压强从2×105Pa增加到5×105 Pa时,D的浓度应变化为0.085mol/L的2.5倍即为0.2125mol/L,而图表中变化为0.20mol/L<0.2125mol/L,说明平衡逆向进行,
故答案为:左;D浓度增大的倍数小于压强增大的倍数;
(2)压强从5×106 Pa 增加到1×106 Pa时,D的浓度应变化为0.20mol/L的2倍即0.4mol/L,而图表中D的浓度为0.44mol/L,说明平衡正向进行,其原因是D浓度增大的倍数大于压强增大的倍数,此时压强增大可能使E液化,使生成物的气体体积减小,
故答案为:右;D浓度增大的倍数大于压强增大的倍数,此时压强增大可能使E液化,使生成物的气体体积减小.
点评 本题考查了化学平衡状态的影响因素,为高考常见题型和高频考点,关键是分析题中表格的数据,得出正确结论,充分考查了学生的分析、理解能力,本题难度中等.

练习册系列答案
相关题目
4.正常人体内低密度脂蛋白胆固醇的含量范围为2.84~3.10μmol•L-1,严,人体内该物质含量升高易导致动脉粥样硬化.你认为这里的μmol•L-1表示的是低密度脂蛋白胆固醇的( )
| A. | 体积数据 | B. | 体积分数 | C. | 质量分数 | D. | 物质的量浓度 |
14.下列有关说法正确的是( )
| A. | 化学平衡向正向移动,反应物浓度一定降低 | |
| B. | 化学平衡向正向移动,生成物的浓度一定增加 | |
| C. | 化学平衡向正向移动,反应物的转化率一定增大 | |
| D. | 化学平衡向正向移动时,正反应速率一定大于逆反应速率 |
11.氢能的存储是氢能应用的主要瓶颈,开发新型储氢材料是氢能利用的重要研究方向,目前所采用或正在研究的主要储氢材料有:配位氢化物、富氢载体化合物、碳质材料、金属氢化物等.
(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料.
①基态Ti2+中含有的电子数为20,电子占据的最高能级是3d,该能级具有的原子轨道数为5.
②BH4-中的B原子的杂化方式是sp3.
(2)金属氢化物是具有良好发展前景的储氢材料.
①LiH中,离子半径:Li+<(填“>”“<”或“=”)H-.
②某储氢材料是短周期金属元素M的氢化物,M的部分电离能如表所示:
该氢化物的化学式为MgH2.
(3)液氨是富氢物质,是氢能的理想载体.
①NH3的相对分子质量小于PH3,但NH3的沸点却远高于PH3,其原因是氨气分子之间可以形成氢键.
②NH3容易和分子中有空轨道的BF3反应形成新的化合物(用“→”表示配位键),该化合物的结构式为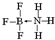 .
.
(4)2008年,Yoon等人发现Ca与C60(分子结构如图甲)生成的Ca32C60能大量吸附H2分子.
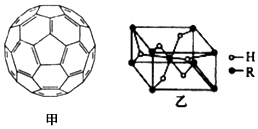
①C60晶体易溶于苯、CS2,C60是非极性(填“极性”或“非极性”)分子.
②1mol C60分子中,含有σ 键数目为90NA个.(阿伏加德罗常数数值为NA)
(5)某金属氢化物储氢材料的晶胞结构如图乙所示,该金属氢化物的化学式为H2R.已知该晶体的密度为a g•cm-3,金属元素R的相对原子质量为M,阿伏加德罗常数数值为NA,则该晶胞的体积为$\frac{2M+4}{{a{N_A}}}$cm3.
(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料.
①基态Ti2+中含有的电子数为20,电子占据的最高能级是3d,该能级具有的原子轨道数为5.
②BH4-中的B原子的杂化方式是sp3.
(2)金属氢化物是具有良好发展前景的储氢材料.
①LiH中,离子半径:Li+<(填“>”“<”或“=”)H-.
②某储氢材料是短周期金属元素M的氢化物,M的部分电离能如表所示:
| I1/kJ•mol-1 | I2/kJ•mol-1 | I3/kJ•mol-1 | I4/kJ•mol-1 | I5/kJ•mol-1 |
| 738 | 1451 | 7733 | 10540 | 13630 |
(3)液氨是富氢物质,是氢能的理想载体.
①NH3的相对分子质量小于PH3,但NH3的沸点却远高于PH3,其原因是氨气分子之间可以形成氢键.
②NH3容易和分子中有空轨道的BF3反应形成新的化合物(用“→”表示配位键),该化合物的结构式为
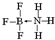 .
.(4)2008年,Yoon等人发现Ca与C60(分子结构如图甲)生成的Ca32C60能大量吸附H2分子.

①C60晶体易溶于苯、CS2,C60是非极性(填“极性”或“非极性”)分子.
②1mol C60分子中,含有σ 键数目为90NA个.(阿伏加德罗常数数值为NA)
(5)某金属氢化物储氢材料的晶胞结构如图乙所示,该金属氢化物的化学式为H2R.已知该晶体的密度为a g•cm-3,金属元素R的相对原子质量为M,阿伏加德罗常数数值为NA,则该晶胞的体积为$\frac{2M+4}{{a{N_A}}}$cm3.
18.某研究小组利用图装置探究CO还原Fe2O3所得到的一种黑色粉末的成分(固定装置略去).(已知:Fe2+遇到K3溶液生成蓝色沉淀)

请回答问題:
(1)按气流方向,各仪器接口从左到右的连接顺序为:
i→c→d→g→h→a→b→j→k→f→e.(填字母编号)
(2)证明Fe2O3己被还原的现象是F中的固体由红棕色变黑色,C中溶液变浑浊.
(3)研究小组对黑色粉末的成分提出下列猜想:
【猜想一】黑色粉末的成分可能是Fe.
【猜想二】黑色粉末的成分可能是FeO.
【猜想三】黑色粉末的成分可能是Fe3O4.
设计并完成实验如表:
①根据实验现象,则猜想三成立.
②研究小组又向步骤3的溶液中滴加新制氯水,发现溶液红色褪去.可能的原因及验证方法为假设SCN-被Cl2氧化,向溶液中加入KSCN溶液,若出现红色,则假设成立.
(4)上述装置还有不妥之处,改进措施为在整套装置的尾气出口处,放置一燃着的酒精灯(或用导管将尾气引至F处酒精灯点燃).

请回答问題:
(1)按气流方向,各仪器接口从左到右的连接顺序为:
i→c→d→g→h→a→b→j→k→f→e.(填字母编号)
(2)证明Fe2O3己被还原的现象是F中的固体由红棕色变黑色,C中溶液变浑浊.
(3)研究小组对黑色粉末的成分提出下列猜想:
【猜想一】黑色粉末的成分可能是Fe.
【猜想二】黑色粉末的成分可能是FeO.
【猜想三】黑色粉末的成分可能是Fe3O4.
设计并完成实验如表:
| 步骤 | 操作 | 现象 |
| 1 | 加入稀盐酸 | 溶解,无气泡 |
| 2 | 取步骤1中溶液,滴加K3[Fe(CN)6]溶液 | 蓝色沉淀 |
| 3 | 取步骤1中溶液,滴加KSCN溶液 | 变红 |
②研究小组又向步骤3的溶液中滴加新制氯水,发现溶液红色褪去.可能的原因及验证方法为假设SCN-被Cl2氧化,向溶液中加入KSCN溶液,若出现红色,则假设成立.
(4)上述装置还有不妥之处,改进措施为在整套装置的尾气出口处,放置一燃着的酒精灯(或用导管将尾气引至F处酒精灯点燃).
12.生活中的一些问题常涉及化学知识,下列叙述错误的是( )
| A. | 纤维素在人体内可以水解成葡萄糖 | |
| B. | 组成蛋白质的元素中,一定含有碳、氢、氧、氮 | |
| C. | 适量摄入油脂,有助于人体吸收多种脂溶性维生素 | |
| D. | 天然蛋白质水解后的最终产物是a-氨基酸 |
13.CaC2和ZnC2、Al4C3、Mg2C3、Li2C2等都同属于离子型碳化物.请通过对CaC2制C2H2的反应进行思考,从中得到必要的启示,判断下列反应产物 不正确的是( )
| A. | ZnC2水解生成C2H2 | B. | A14C3水解生成C3H4 | ||
| C. | Mg2C3水解生成C3H4 | D. | Li2C2水解生成C2H2 |
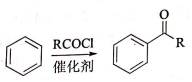 ②
②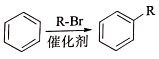
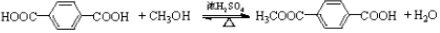 .
.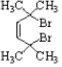 .
.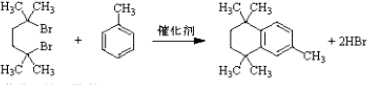 .
.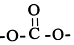 结构)
结构)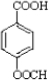 ,
,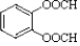 .
.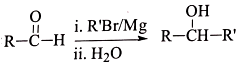 R-CH-R′(R、R′为烃基)
R-CH-R′(R、R′为烃基)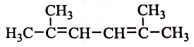 ,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件).
,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件).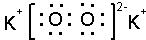 ;
;