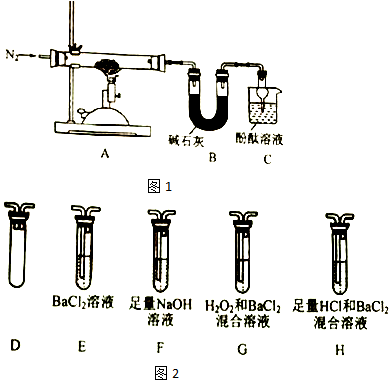
题目内容
1.下列化学式表示的物质一定是纯净物的是( )| A. | C4H10 | B. | C | C. |  | D. | C2H6O |
分析 A、丁烷有正丁烷和异丁烷两种同分异构体;
B、碳元素有石墨、金刚石和C60三种同素异形体;
C、 只能表示溴苯;
只能表示溴苯;
D、C2H6O的同分异构体有两种,即乙醇和二甲醚.
解答 解:A、丁烷有正丁烷和异丁烷两种同分异构体,故C4H10可能是正丁烷,还可能为异丁烷,还可能为正丁烷和异丁烷的混合物,故不一定是纯净物,故A错误;
B、碳元素有石墨、金刚石和C60三种同素异形体,故C可能是石墨,也可能是金刚石,还可能是两者的混合物,故不一定是纯净物,故B错误;
C、 只能表示溴苯,故一定是纯净物,故C正确;
只能表示溴苯,故一定是纯净物,故C正确;
D、C2H6O的同分异构体有两种,即乙醇和二甲醚,故C2H6O可能表示的是乙醇,还可能表示的是二甲醚,还可能是两者的混合物,故不一定是纯净物,故D错误.
故选C.
点评 本题借助考查纯净物和混合物的辨析,实际是考查了有机物的同分异构体的书写以及同素异形体的记忆,难度不大,掌握好基础是关键.

练习册系列答案
 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案
相关题目
11.氢能的存储是氢能应用的主要瓶颈,开发新型储氢材料是氢能利用的重要研究方向,目前所采用或正在研究的主要储氢材料有:配位氢化物、富氢载体化合物、碳质材料、金属氢化物等.
(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料.
①基态Ti2+中含有的电子数为20,电子占据的最高能级是3d,该能级具有的原子轨道数为5.
②BH4-中的B原子的杂化方式是sp3.
(2)金属氢化物是具有良好发展前景的储氢材料.
①LiH中,离子半径:Li+<(填“>”“<”或“=”)H-.
②某储氢材料是短周期金属元素M的氢化物,M的部分电离能如表所示:
该氢化物的化学式为MgH2.
(3)液氨是富氢物质,是氢能的理想载体.
①NH3的相对分子质量小于PH3,但NH3的沸点却远高于PH3,其原因是氨气分子之间可以形成氢键.
②NH3容易和分子中有空轨道的BF3反应形成新的化合物(用“→”表示配位键),该化合物的结构式为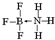 .
.
(4)2008年,Yoon等人发现Ca与C60(分子结构如图甲)生成的Ca32C60能大量吸附H2分子.
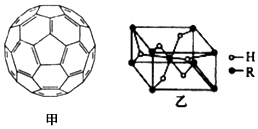
①C60晶体易溶于苯、CS2,C60是非极性(填“极性”或“非极性”)分子.
②1mol C60分子中,含有σ 键数目为90NA个.(阿伏加德罗常数数值为NA)
(5)某金属氢化物储氢材料的晶胞结构如图乙所示,该金属氢化物的化学式为H2R.已知该晶体的密度为a g•cm-3,金属元素R的相对原子质量为M,阿伏加德罗常数数值为NA,则该晶胞的体积为$\frac{2M+4}{{a{N_A}}}$cm3.
(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料.
①基态Ti2+中含有的电子数为20,电子占据的最高能级是3d,该能级具有的原子轨道数为5.
②BH4-中的B原子的杂化方式是sp3.
(2)金属氢化物是具有良好发展前景的储氢材料.
①LiH中,离子半径:Li+<(填“>”“<”或“=”)H-.
②某储氢材料是短周期金属元素M的氢化物,M的部分电离能如表所示:
| I1/kJ•mol-1 | I2/kJ•mol-1 | I3/kJ•mol-1 | I4/kJ•mol-1 | I5/kJ•mol-1 |
| 738 | 1451 | 7733 | 10540 | 13630 |
(3)液氨是富氢物质,是氢能的理想载体.
①NH3的相对分子质量小于PH3,但NH3的沸点却远高于PH3,其原因是氨气分子之间可以形成氢键.
②NH3容易和分子中有空轨道的BF3反应形成新的化合物(用“→”表示配位键),该化合物的结构式为
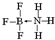 .
.(4)2008年,Yoon等人发现Ca与C60(分子结构如图甲)生成的Ca32C60能大量吸附H2分子.

①C60晶体易溶于苯、CS2,C60是非极性(填“极性”或“非极性”)分子.
②1mol C60分子中,含有σ 键数目为90NA个.(阿伏加德罗常数数值为NA)
(5)某金属氢化物储氢材料的晶胞结构如图乙所示,该金属氢化物的化学式为H2R.已知该晶体的密度为a g•cm-3,金属元素R的相对原子质量为M,阿伏加德罗常数数值为NA,则该晶胞的体积为$\frac{2M+4}{{a{N_A}}}$cm3.
12.生活中的一些问题常涉及化学知识,下列叙述错误的是( )
| A. | 纤维素在人体内可以水解成葡萄糖 | |
| B. | 组成蛋白质的元素中,一定含有碳、氢、氧、氮 | |
| C. | 适量摄入油脂,有助于人体吸收多种脂溶性维生素 | |
| D. | 天然蛋白质水解后的最终产物是a-氨基酸 |
9.以下是一些分子的比例模型,其中空间结构和原子大小比例错误的是( )
| A. |  NH3 NH3 | B. |  H2O H2O | C. |  HCl HCl | D. |  CCl4 CCl4 |
16.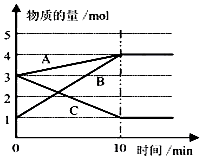 化学反应速率与限度与生产、生活密切相关
化学反应速率与限度与生产、生活密切相关
(1)A学生为了探究锌与盐酸反应过程中的速率变化,他在200mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
①反应速率最大的时间段是(指0~1、1~2、2~3、3~4、4~5 )2~3 min,原因是因该反应放热,随着反应,溶液温度升高,故反应速率加快.
②求2~3分钟时间段以盐酸的浓度变化来表示的该反应速率0.1mol/(L•min).(设溶液体积不变)
(2)B学生也做同样的实验,但由于反应太快,测不准氢气体积,故想办法降低反应速率,请你帮他选择在盐酸中加入下列AB以减慢反应速率.(填写代号)
A.蒸馏水 B.冰块 C.HNO3溶液 D.CuSO4溶液
(3)某温度下在10L密闭容器中,3种气态物质A、B、C的物质的量随时间变化曲线如图.
①该反应的化学方程式是2C?A+3B.
②求在该条件达到反应的限度(平衡状态)时反应物的转化率【转化率=$\frac{转化的物质的量}{初始物质的量}$×100%】,请写出计算过程,计算结果保留1位小数)
 化学反应速率与限度与生产、生活密切相关
化学反应速率与限度与生产、生活密切相关(1)A学生为了探究锌与盐酸反应过程中的速率变化,他在200mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL)(标准状况) | 100 | 240 | 464 | 576 | 620 |
②求2~3分钟时间段以盐酸的浓度变化来表示的该反应速率0.1mol/(L•min).(设溶液体积不变)
(2)B学生也做同样的实验,但由于反应太快,测不准氢气体积,故想办法降低反应速率,请你帮他选择在盐酸中加入下列AB以减慢反应速率.(填写代号)
A.蒸馏水 B.冰块 C.HNO3溶液 D.CuSO4溶液
(3)某温度下在10L密闭容器中,3种气态物质A、B、C的物质的量随时间变化曲线如图.
①该反应的化学方程式是2C?A+3B.
②求在该条件达到反应的限度(平衡状态)时反应物的转化率【转化率=$\frac{转化的物质的量}{初始物质的量}$×100%】,请写出计算过程,计算结果保留1位小数)
6.用括号内的试剂或分离方法,除去下列各物质中少量的杂质或分离出物质,正确的是( )
| A. | 苯中的溴(碘化钾溶液) | B. | 汽油中的苯(水) | ||
| C. | 煤焦油中的苯、甲苯、二甲苯(分液) | D. | 甲烷中的乙烯(溴水) |
13.CaC2和ZnC2、Al4C3、Mg2C3、Li2C2等都同属于离子型碳化物.请通过对CaC2制C2H2的反应进行思考,从中得到必要的启示,判断下列反应产物 不正确的是( )
| A. | ZnC2水解生成C2H2 | B. | A14C3水解生成C3H4 | ||
| C. | Mg2C3水解生成C3H4 | D. | Li2C2水解生成C2H2 |
11.对某温度下的可逆反应N2(g)+3H2(g)?2NH3(g).下列事实能说明该反应达到化学平衡状态的是( )
| A. | N2、H2的浓度之比保持不变 | |
| B. | N2和H2的反应速率之比为1:3 | |
| C. | NH3的生成速率与H2的生成速率之比为2:3 | |
| D. | 体系中N2、H2、NH3的分子个数之比为1:3:2 |